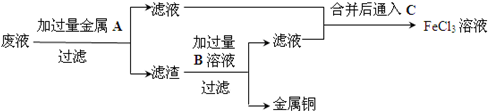
题目内容
10.蛇纹石由MgO、A12O3、SiO2、Fe2O3组成.现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )| A. | 沉淀X的成分是SiO2、Fe2O3 | |
| B. | 从蛇纹石组成看,其成分皆是碱性氧化物 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 在溶液Y中加入过量的氨水,过滤得到的沉淀是Al(OH)3、Fe(OH)3和Mg(OH)2 |
分析 四种氧化物中,MgO、Fe2O3属于碱性氧化物,Al2O3属于两性氧化物,溶于盐酸生成MgCl2、AlCl3、FeCl3,溶液中的阳离子主要是Mg2+、Al3+、Fe3+、H+,SiO2属于酸性氧化物,不溶于盐酸,因此过滤出的沉淀是SiO2,以此解答该题.
解答 解:A.Fe2O3可与盐酸反应生成Fe3+和水,SiO2属于酸性氧化物,不溶于盐酸,因此过滤出的沉淀是SiO2,故A错误;
B.蛇纹石由MgO、A12O3、SiO2、Fe2O3组成,MgO,Fe2O3是碱性氧化物,A12O3是两性氧化物,SiO2是酸性氧化物,故B错误;
C.MgO、A12O3、Fe2O3都能与过量盐酸反应生成金属阳离子,且酸过量,则溶液Y中主要是Mg2+、Al3+、Fe3+、H+,故C正确;
D.在溶液Y中加入过量的氨水,氢氧化铝是两性氢氧化物不溶于弱酸弱碱,所以过滤得到的沉淀的成分是Fe(OH)3、Mg(OH)2、Al(OH)3,故D正确.
故选CD.
点评 本题考查常见氧化物的性质,侧重于元素化合物知识的综合应用,为高考常见题型,题中注意氧化铝和二氧化硅的性质,难度不大.

练习册系列答案
相关题目
6.纤维素分子中的每个单糖单元有3个醇羟基,关于纤维素分子的下列说法,错误的是( )
| A. | 能跟硝酸发生化合反应 | |
| B. | 能跟硝酸发生酯化反应 | |
| C. | 能跟乙酸反应生成乙酸酯 | |
| D. | 1mol单糖单元必定和3mol硝酸发生反应,少于3mol则不能反应 |
1.下列溶液中,与Cu不能发生反应的是( )
| A. | 浓H2SO4(热) | B. | 浓HNO3(常温) | C. | 浓盐酸(热) | D. | 稀HNO3(热) |
18.能除去CH4中少量CH2═CH-CH3的最好方法是( )
| A. | 通入足量溴水中 | B. | 点燃 | ||
| C. | 催化加氢 | D. | 通入足量酸性KMnO4溶液中 |
2.把a mol C2H4跟b mol H2混合在密闭容器中,在适当条件下,反应达到平衡时生成p molC2H6,若将所得平衡混和气体完全燃烧生成二氧化碳和水,需要氧气的量是( )
| A. | (3a+b)mol | B. | (3a+$\frac{b}{2}$)mol | C. | (3a+3p+$\frac{b}{2}$)mol | D. | (3a+$\frac{b}{2}$-3p)mol |
19.下列关于电化学的叙述正确的是( )
| A. | 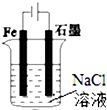 图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红 | |
| B. | 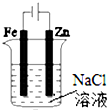 图②装置可以验证牺牲阳极的阴极保护法 | |
| C. |  图③可以模拟钢铁的吸氧腐蚀,铁棒一极的电极反应式:Fe=Fe 2++2e- | |
| D. | 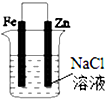 分别给上述4个装置的铁电极附近滴加少量K3[Fe(CN)6]溶液,②④出现蓝色沉淀 |


 反应类型为氧化反应.
反应类型为氧化反应. )的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有
)的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有 )为原料可以合成聚酯PTT,写出其化学方程式
)为原料可以合成聚酯PTT,写出其化学方程式 .
.
 ,请你设计出合理的反应流程图
,请你设计出合理的反应流程图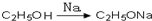 、
、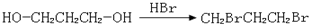 、
、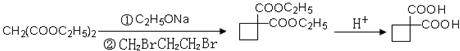 .提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A$→_{反应条件}^{反应物}$ B$→_{反应条件}^{反应物}$ C …
.提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A$→_{反应条件}^{反应物}$ B$→_{反应条件}^{反应物}$ C …