题目内容
17.如表为元素周期表的一部分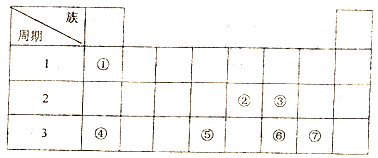
用化学用语回答下列问题:
(1)元素③⑥的气态氢化物沸点大小为H2O>H2S(填化学式):原因是水分子间有氢键
(2)②③⑤的原子半径由大到小的顺序为Si>N>O;(填化学式)
(3)①④形成的化合物的电子式为Na+[:H]-:该化合物与水反应的离子方程式为NaH+H2O=Na++OH-+H2 ↑
(4)元素④与元素②的物质的量比为1:3时,所形成的化合物是汽车安全气囊的成分,该化 合物在撞击时会发生分解反应,该分解反应的化学方程式为2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑
(5)将22.4L②的含氧化合物与足量的灼热铜粉完全反应后,气体体积变为11.2L(体积均在相同条件下测定),则该氧化合物的化学式可能为D
A.N2O3 B.N2O4 C.N2O D.NO2.
分析 由元素在周期表中位置,可知①为H、②为N、③为O、④为Na、⑤为Si、⑥为S、⑦为Cl,
(1)水分子之间存在氢键,沸点比较硫化氢的高;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)NaH为离子化合物,Na失去1个电子,H得到一个电子,NaH与水反应生成氢气和氢氧化钠;
(4)依据叠氮酸钠分解产生氮气和钠回答;
(5)根据该氮氧化合物与足量的灼热铜粉完全反应的原理以及气体体积差量法来计算.
解答 解:(1)水分子之间存在氢键,沸点比较硫化氢的高,故答案为:H2O>H2S;水分子间有氢键;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Si>N>O,故答案为:Si>N>O;
(3)NaH是离子化合物,由Na+和H-离子组成,电子式为Na+[:H]-,与水反应生成氢氧化钠和氢气,氢氧化钠可拆,离子反应方程式为:NaH+H2O=Na++OH-+H2↑,
故答案为:Na+[:H]-;NaH+H2O=Na++OH-+H2↑;
(4)叠氮酸钠受到撞击生成氮气和钠,化学反应方程式为:2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑;故答案为:2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑;
(5)假设反应为:2NxOy+2yCu$\frac{\underline{\;\;△\;\;}}{\;}$2yCuO+xN2,根据题中数据,反应后气体体积为反应前气体体积的一半,即可以得到x=1,
因为4Cu+2NO2=4CuO+N2,方程式的系数之比等于物质的量之比,所以反应前有NO222.4L即1mol,所以反应后有N20.5mol,所以是NO2 ,故答案为:D.
点评 本题考查元素周期表与元素周期律,难度不大,注意掌握元素金属性、非金属性强弱比较与实验事实.

| A. | 较强酸可以制取较弱酸,推出H2S不能制取H2SO4 | |
| B. | 组成和结构相似的物质,沸点随相对分子质量增大而升高,推出SiH4沸点高于CH4 | |
| C. | 电解氯化铜溶液可得到Cu;则电解食盐水可以得到Na | |
| D. | 1mol O2和Mg完全反应获得4mol电子;则1mo1 O2和其他金属完全反应都获得4mol电子 |
| A. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| B. | 乙醇、乙烯、乙醛都能使酸性高锰酸钾溶液褪色 | |
| C. | 豆科作物根瘤菌将含氮化合物转化为蛋白质是氮的固定 | |
| D. | 核电站泄漏的放射性碘-131(${\;}_{53}^{131}$I)、铯-137(${\;}_{55}^{137}$Cs)互称同位素,可使蛋白质变性 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | Fe2O3 SO2 NH3 H2O | B. | FeO SO3 NH3 H2O | ||
| C. | Fe2O3 SO2 SO3NH3 H2O | D. | FeO SO2 NH3 H2O |
| A. | 能跟硝酸发生化合反应 | |
| B. | 能跟硝酸发生酯化反应 | |
| C. | 能跟乙酸反应生成乙酸酯 | |
| D. | 1mol单糖单元必定和3mol硝酸发生反应,少于3mol则不能反应 |
| A. | 浓H2SO4(热) | B. | 浓HNO3(常温) | C. | 浓盐酸(热) | D. | 稀HNO3(热) |

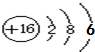 ,写出戊的电子式
,写出戊的电子式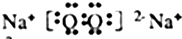 ;
; NaHCO3+NaOH;(用化学反应方程式表示)
NaHCO3+NaOH;(用化学反应方程式表示)