题目内容
8.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合.下列关于C3N4晶体说法错误的是( )| A. | 该晶体属于原子晶体,其化学键比金刚石更牢固 | |
| B. | 该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子 | |
| C. | 该晶体中碳原子和氮原子的最外层都满足8电子结构 | |
| D. | 该晶体与金刚石相似,原子间都是非极性键 |
分析 C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合,则C3N4晶体为原子晶体,碳最外层有4个电子,氮最外层有5个电子,则每个碳原子连接4个氮原子、每个氮原子连接3个碳原子,以此来解答.
解答 解:A.晶体具有比金刚石还大的硬度,则该晶体属于原子晶体,其化学键比金刚石更牢固,故A正确;
B.碳最外层有4个电子,氮最外层有5个电子,则该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子,故B正确;
C.构成该晶体的微粒间只以单键结合,每个碳原子连接4个氮原子、每个氮原子连接3个碳原子,则晶体中碳原子和氮原子的最外层都满足8电子结构,故C正确;
D.金刚石中只存在C-C键,属于非极性共价键,但C3N4晶体中C、N之间以极性共价键结合,原子间以极性键形成空间网状结构,故D错误,
故选D.
点评 本题以信息的形式考查原子晶体的性质及结构,明确晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合是解答本题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.已知KClO3+5KCl+3H2SO4=3K2SO4+3Cl2↑+3H2O,下列说法不正确的是( )
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 1 mol KClO3参加反应时有10 mol电子转移 |
19.仅用提供的硅酸盐仪器(非硅酸盐仪器任选),不能达到相应实验目的是( )
| A. | 提纯粗盐:烧杯、玻璃棒、酒精灯、蒸发皿 | |
| B. | 除去CO2气体中混有的少量HCl:导管、洗气瓶 | |
| C. | 用CCl4提取碘水中的碘:分液漏斗、烧杯 | |
| D. | 用18.4 mol•L-1浓硫酸配制100mL 1.0 mol•L-1硫酸:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |
16.下列各装置能够达到相应实验目的是( )
| A. | 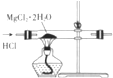 制取无水MgCl2 | B. |  除去CO2气体中的HCl气体 | ||
| C. | 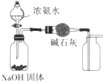 制取并收集干燥纯净的NH3 | D. | 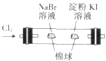 证明氧化性:Cl2>Br2>I2 |
3.草酸是二元弱酸,草酸氢钾溶液呈酸性.在0.1mol•L-1KHC2O4溶液中,下列关系正确的是( )
| A. | c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) | B. | c(HC2O4-)+c(C2O42-)=0.1mol•L-1 | ||
| C. | c(C2O42-)>c(H2C2O4) | D. | c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
13.常温下,在含CH3COOH和CH3COONa均为0.1mol/L的溶液中,测得pH<7,则下列说法中正确的是( )
| A. | c(CH3COO-)<c(Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)>c(Na+) |
20.下列与有关非金属元素叙述以及推理结果不正确的是( )
| A. | 非金属性Cl>Br,故将Cl2通入NaBr溶液中,发生反应为:Cl2+2Br-=Br2+2Cl- | |
| B. | 非金属性F>Br,故酸性:HF>HBr | |
| C. | 非金属性S>33As,故前者的气态氢化物稳定性更强 | |
| D. | 非金属性O>N,故O2与H2化合比N2更容易 |
17.下列有关物质结构的表述正确的是( )
| A. | H2O2的电子式: | B. | CO2的比例模型: | ||
| C. | 14C的原子结构示意图: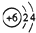 | D. | CCl4的结构式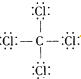 |
9.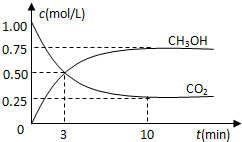 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 进行到3分钟时,正反应速率和逆反应速率相等 | |
| B. | 10分钟后容器中各物质浓度不再改变 | |
| C. | 达到平衡后,升高温度,正反应速率增大、逆反应速率减小 | |
| D. | 3min前v正>v逆,3min后v正<v逆 |