题目内容
1. 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:| 元素 | 性质或结构信息 |
| A | 单质为黄色粉末,难溶于水,能形成2种二元含氧酸 |
| B | M层有1个未成对的p电子,核外电子总数大于7 |
| C | 与锂形成的合金常用于航天飞行器,单质能溶于强酸和强碱 |
| D | S电子总数比p电子总数少2个,单质或氧化物均具有很高的熔、沸点 |
| E | 周期表中电负性最大的元素 |
| F | 最外层有2个电子,但次外层有18个电子 |
 .
.(2)C与D元素第一电离能的大小关系:Si>Al(填元素符号);
(3)A、B两元素的氢化的分子中键能较小的是H2S(填分子式,下同),分子较稳定的是HCl;
(4)C的单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(5)A的氢化物分子中的中心原子的杂化方式为sp3,F的离子可与氨分子形成[F(NH3)4]2+,该阳离子中存在的化学键类型有共价键和配位键;
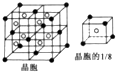
(6)E与钙可组成离子化合物,其晶细胞结构如图所示,该化合物的电子式为
 .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
分析 A单质常温下为固体,难溶于水易于溶CS2,能形成2种二元含氧酸,因此A为S;B原子的M层有1个未成对的p电子,核外p电子总数大于7,则B应该是Cl;C单质与锂形成的合金常用于航天飞行器,单质能溶强酸和强碱,所以C为Al;D原子核外电子层上s电子总数比p电子总数少2个,单质和氧化物均为空间网状晶体,具有很高的熔、沸点,则D为Si;E是周期表中电负性最大的元素是F,即E为F元素;F最外层有2个电子,但次外层有18个电子,则F的原子序数为30,为Zn元素,据此进行解答.
解答 解:A单质常温下为固体,难溶于水易于溶CS2,能形成2种二元含氧酸,因此A为S;B原子的M层有1个未成对的p电子,核外p电子总数大于7,则B应该是Cl;C单质与锂形成的合金常用于航天飞行器,单质能溶强酸和强碱,所以C为Al;D原子核外电子层上s电子总数比p电子总数少2个,单质和氧化物均为空间网状晶体,具有很高的熔、沸点,则D为Si;E是周期表中电负性最大的元素是F,即E为F元素;F最外层有2个电子,但次外层有18个电子,则F的原子序数为30,为Zn元素,
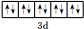
(1)A为S元素,S元素位于第三周期第ⅥA族,所以S原子的最外层电子排布式为:3s23p4;D为Si元素,Si元素的原子序数是14,核外电子数是14个,所以Si原子共有14种不同运动状态的电子;F离子为锌离子,其价层电子为3d轨道的10个电子,其价层电子的排布图为: ,
,
故答案为:3s23p4;14; ;
;
(2)非金属性越强,第一电离能越大,金属性越强,第一电离能越小,所以二者的第一电离能大小为:Si>Al,
故答案为:Si;Al;
(3)非金属性是S弱于Cl,所以两种元素的氢化物分子中键能较小的是H2S;非金属性越强,氢化物的稳定性越强,因此分子较稳定的是HCl,
故答案为:H2S;HCl;
(4)原电池中较活泼的金属做负极,镁的金属性强于Al,但由于铝能和氢氧化钠溶液,而镁不能,所以单质铝、镁、NaOH溶液构成的原电池中铝是负极,镁是正极,因此负极的电极反应式为:Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(5)A为S元素,其氢化物为H2S,H2S中O形成2个δ键,孤电子对数=$\frac{6-2×1}{2}$=2,所以S原子采用sp3杂化;
F为Zn,[F(NH3)4]2+为[Zn(NH3)4]2+,N原子和Zn原子之间存在配位键,NH3中H和N之间存在共价键,所以该阳离子中存在的化学键类型为共价键和配位键,
故答案为:sp3;共价键和配位键;
(6)E为F原子,根据晶胞的结构图并依据均摊原理可知,氟原子的个数为8,钙原子的个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个,因此该化合物的化学式为CaF2,含有离子键的离子化合物,因此其电子式为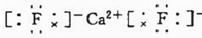 ;
;
已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,则该晶胞的体积是8×2.0×10-23cm3,
因此根据晶胞中钙离子的个数是4个可知:$\frac{ρ×8×2.0×1{0}^{-23}c{m}^{3}}{78g/mol}$×6.02×1023/mol=4,
解得:ρ=$\frac{78g/mol×4}{8×2.0×1{0}^{-23}×c{m}^{3}×6.02×1{0}^{23}/mol}$=3.2g/cm3,
故答案为: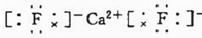 ;3.2g/cm3.
;3.2g/cm3.
点评 本题考查了位置、结构与性质关系的应用、晶胞的计算,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用基础知识的能力,注意熟练掌握原子结构与元素周期律、元素周期表的关系,(6)中的晶胞计算为难点,注意掌握晶胞计算的方法与技巧.

| 实验序号 | 温度T/℃ | A溶液 | B溶液 |
| ① | 30 | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20 | 20mL0.1mol•L-1H2S2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是:①<②(填:>、<、=).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol/L.
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+(或MnSO4)是反应的催化剂②该反应放热.
| A. | 8+$\frac{1}{2}$ lg2 | B. | 9+lg2 | C. | 10+$\frac{1}{2}$ lg2 | D. | 11+2lg2 |
I.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.
然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
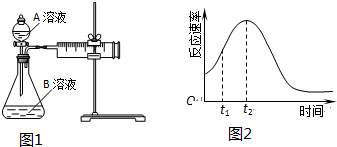
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图所示.
下列说法不正确的是BC.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液都可以作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
Ⅲ.冶炼铁
(5)化工厂利用菱铁矿(主要成分是碳酸亚铁)冶炼铁的原理是(用化学方程式表示):FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2↑,FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.生铁炼钢的主要原理是高温下,用氧化剂降低生铁中碳等杂质含量.
(6)生铁在湿润空气中发生电化学腐蚀最终生成红色铁锈,金属电化腐蚀类型为吸氧腐蚀.
| A. | 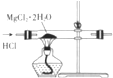 制取无水MgCl2 | B. |  除去CO2气体中的HCl气体 | ||
| C. | 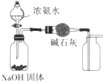 制取并收集干燥纯净的NH3 | D. | 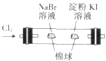 证明氧化性:Cl2>Br2>I2 |
| A. | v(C)=0.5mol/(L•min) | B. | x=3 | ||
| C. | B的转化率为25% | D. | 平衡时C的体积分数为28.6% |
| A. | c(CH3COO-)<c(Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)>c(Na+) |
| A. | V(N2)=V╯(NH3) | B. | V(N2)=3V(H2) | ||
| C. | V(H2)=3/2V╯(NH3) | D. | N2,H2,NH3的体积比为1:3:2 |
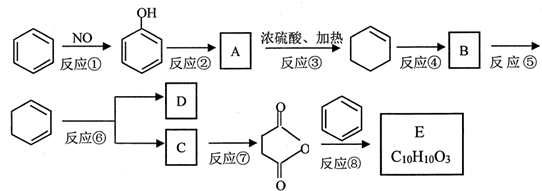
 +(CH3CO)2O→
+(CH3CO)2O→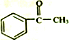 +CH3COOH
+CH3COOH ;B
;B .
. 直接制取
直接制取 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.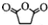 +
+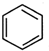 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$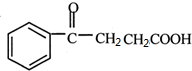 .
.