题目内容
【题目】高锰酸钾消毒片主要成分为KMnO4,可外用消炎杀菌。用某软锰矿(主要成分是MnO2,还含有A12O3、SiO2等杂质)制备KMnO4的流程图如下:
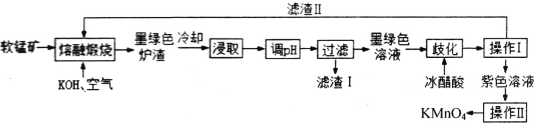
已知:K2MnO4固体和溶液均为墨绿色,溶液呈碱性且能发生可逆的歧化反应。
(1)“操作I”中玻璃棒的作用是____________。“操作Ⅱ”时,当__________时,停止加热,自然冷却,抽滤后即可获得紫黑色KMnO4晶体。
(2)向“浸取液”中通入CO2,调节其pH,经“过滤”得滤渣I,滤渣I的成分为__________。
(3)“熔融煅烧”时,MnO2参与反应的化学方程式为_________________________。
(4)“歧化”时,加入冰醋酸的目的是___________________________(用必要的离子方程式和文字解释)。
(5)“歧化”时,下列酸可以用来代替冰醋酸的是___________(填字母)。
a.浓盐酸 b.亚硫酸 c.稀硫酸 d.氢碘酸
(6)制取过程中,若pH调节不合理易生成Mn2+。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含0.05mol·L-1Mn2+废水中通入一定量H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=__________。[已知:H2S的Ka1=1.3×10-7 Ka2=5.0×10-15;Ksp(MnS)=2.5×10-14]
【答案】引流 表面出现晶膜 Al(OH)3和H2SiO3 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O 调节溶液pH,使3MnO42-+2H2O
2K2MnO4+2H2O 调节溶液pH,使3MnO42-+2H2O ![]() 2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率 c 6
2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率 c 6
【解析】
软锰矿(主要成分为MnO2,还含有Al2O3、SiO2等杂质)与KOH在空气中熔融煅烧,主要的反应为:2MnO2+4KOH+O2![]() 2K2MnO4+2H2O,Al2O3、SiO2得到KAlO2和K2SiO3,冷却浸取,向浸取液中通入CO2调节其pH,KAlO2和K2SiO3转化为Al(OH)3和H2SiO3,过滤,滤渣I主要为Al(OH)3和H2SiO3,墨绿色溶液主要含有K2MnO4,加入冰醋酸歧化,促进平衡3MnO42++2H2O
2K2MnO4+2H2O,Al2O3、SiO2得到KAlO2和K2SiO3,冷却浸取,向浸取液中通入CO2调节其pH,KAlO2和K2SiO3转化为Al(OH)3和H2SiO3,过滤,滤渣I主要为Al(OH)3和H2SiO3,墨绿色溶液主要含有K2MnO4,加入冰醋酸歧化,促进平衡3MnO42++2H2O![]() 2MnO4-+MnO2↓+4OH-右移,过滤,滤渣II为MnO2,滤液为高锰酸钾溶液,结晶得到产品。
2MnO4-+MnO2↓+4OH-右移,过滤,滤渣II为MnO2,滤液为高锰酸钾溶液,结晶得到产品。
(1)操作I为过滤,玻璃棒起到引流作用,操作Ⅱ为结晶操作,“结晶”时,当表面出现晶膜时,停止加热,自然冷却,抽滤后即可获得紫黑色KMnO4晶体,
故答案为:引流;表面出现晶膜;
(2)通入CO2调节其pH,KAlO2和K2SiO3转化为Al(OH)3和H2SiO3,过滤,滤渣I主要为Al(OH)3和H2SiO3,
故答案为:Al(OH)3和H2SiO3;
(3)“熔融煅烧”时,MnO2参与反应的化学方程式为,被氧化生成高锰酸钾,方程式为2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O,
2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O;
2K2MnO4+2H2O;
(4)“歧化”时,加入冰醋酸的目的是调节溶液pH,使3MnO42-+2H2O![]() 2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率,
2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率,
故答案为:调节溶液pH,使3MnO42-+2H2O![]() 2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率;
2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率;
(5)KMnO4具有强氧化性,不能用还原性酸,盐酸、亚硫酸以及氢碘酸均具有还原性,可以用稀硫酸替代醋酸,故答案为:c;
(6)向含Mn2+为0.005mol·L-1的废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol·L-1时,Mn2+开始沉淀,则c(Mn2+)c(S![]() =Ksp(MnS),即0.005×
=Ksp(MnS),即0.005×![]() =2.5×10-15,解得c(H+)=1.0×10-6mol·L-1,即pH=6,
=2.5×10-15,解得c(H+)=1.0×10-6mol·L-1,即pH=6,
故答案为:6。

 阅读快车系列答案
阅读快车系列答案