��Ŀ����
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ����й㷺�Ŀ�����Ӧ��ǰ����������ɱ���ܱ�������Ͷ��0.5molCO��1molH2����ͬ�����·�����Ӧ��CO(g)+2H2(g)![]() CH3OH(g)��ʵ����ƽ��ʱCH3OH�����ʵ������¶ȡ�ѹǿ�ı仯��ͼ1��ʾ������˵����ȷ����
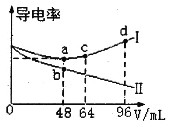
CH3OH(g)��ʵ����ƽ��ʱCH3OH�����ʵ������¶ȡ�ѹǿ�ı仯��ͼ1��ʾ������˵����ȷ����

A.P��1<P��2
B.���������ܶȲ��ٷ����仯��˵���÷�Ӧ�Ѵﵽƽ��״̬
C.ͼ2��M������ȷ��ʾ�÷�Ӧƽ�ⳣ���Ķ���(1gK)���¶ȵĹ�ϵ
D.��P��1=0.25MPa����Y���ƽ�ⳣ��Kp=64(MPa)-2
���𰸡�BD
��������
A�����ڷ�ӦCO��g��+2H2��g��![]() CH3OH��g��������ѹǿ��ƽ�������ƶ����״������ʵ�������
CH3OH��g��������ѹǿ��ƽ�������ƶ����״������ʵ�������
B����������ɱ䣬ƽ��ʱ������������䣬�ܶȲ��䣻
C�������¶ȼ״������ʵ������٣�˵�������¶ȣ�ƽ�������ƶ���
D��X��Y������ͬ�¶��£���ƽ�ⳣ����ͬ��X��״������ʵ���Ϊ0.25mol���ɼ���ƽ��ʱ�����ʵ��������������ѹ����Ϸ�ѹ����ƽ�ⳣ����
A�����ڷ�ӦCO��g��+2H2��g��![]() CH3OH��g��������ѹǿ��ƽ�������ƶ����״������ʵ���������ͼ���֪P��1��P��2����A����
CH3OH��g��������ѹǿ��ƽ�������ƶ����״������ʵ���������ͼ���֪P��1��P��2����A����
B����������ɱ䣬�ﵽƽ��ʱ������������䣬����������������䣬���ܶȲ��䣬��˵���ﵽƽ��״̬����B��ȷ��
C�������¶ȼ״������ʵ������٣�˵�������¶ȣ�ƽ�������ƶ����������¶ȣ�lgK��С��N������ȷ��ʾ�÷�Ӧƽ�ⳣ���Ķ�����1gK�����¶ȵĹ�ϵ����C����
D��X��Y������ͬ�¶��£���ƽ�ⳣ����ͬ��X��״������ʵ���Ϊ0.25mol����

��K��Y��=K��X��= =64��MPa��-2����D��ȷ��
=64��MPa��-2����D��ȷ��
��ѡ��BD��