题目内容
【题目】葡萄糖酸亚铁((C6H11O7)2Fe)是常用的补铁剂,易溶于水,几乎不溶于乙醇。用下图装置制备FeCO3,并利用FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:
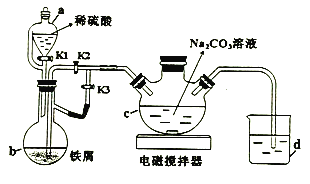
(1)a的名称为_________。
(2)打开a中K1、K3,关闭K2,一段时间后,关闭K3,打开K2。在_________(填仪器标号)中制得碳酸亚铁。实验过程中产生的H2作用有_________、____________。(写2条)
(3)将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色。用化学方程式说明原因____________。
(4)将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是_________________。
(5)用 NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,离子方程式为______________,此法产品纯度更高,原因是_______________。
【答案】恒压滴液漏斗 c 排出装置内的空气,防止生成的FeCO3被氧化 将b中溶液压入c中 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2 降低葡萄糖酸亚铁在水中溶解度 Fe2++2HCO3-=FeCO3↓+H2O+CO2↑ 降低溶液的pH以免产生氢氧化亚铁
【解析】
(1)a的名称为恒压滴液漏斗;
(2)b中产生的硫酸亚铁被氢气压入c中与碳酸钠作用产生碳酸亚铁;实验过程中产生的H2作用还有:排出装置内的空气,防止生成的FeCO3被氧化;
(3)FeCO3与O2反应生成红褐色Fe(OH)3;
(4)乙醇分子的极性比水小,乙醇降低葡萄糖酸亚铁在水中溶解度;
(5)NaHCO3溶液与FeSO4溶液反应生成FeCO3、H2O、CO2和Na2SO4;碳酸根离子水解后溶液碱性较强,易生成氢氧化亚铁。
(1)a的名称为恒压滴液漏斗;
(2)b中产生的硫酸亚铁被压入c中与碳酸钠作用产生碳酸亚铁;实验过程中产生的H2作用有:赶走空气、防止生成的FeCO3被氧化;将b中溶液压入c中;
(3)过滤时间过长会发现产品部分变为红褐色。FeCO3与O2反应生成Fe(OH)3,用化学方程式:4FeCO3+O2+6H2O=4Fe(OH)3+4CO2;
(4)乙醇分子的极性比水小,乙醇降低葡萄糖酸亚铁在水中溶解度,便于葡萄糖酸亚铁析出;
(5)NaHCO3溶液与FeSO4溶液反应生成FeCO3、H2O、CO2和Na2SO4,方程式为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑。碳酸根离子水解后溶液碱性较强,易生成氢氧化亚铁,此法产品纯度更高的原因是:降低溶液的pH以免产生氢氧化亚铁。

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项所列对应关系均正确的一组是

选项 | X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-=O2↑+2H2O |
C | 负极 | CuCl2溶液 | b管中有气体逸出 |
D | 负极 | NaOH溶液 | 溶液PH降低 |
A. A B. B C. C D. D




