题目内容
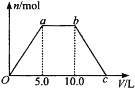
【题目】甲图是部分短周期元素的常见化合价与原子序数的关系图:
请回答下列问题:
(1)D元素在周期表中的位置为___________,D和G的简单氢化物中沸点高的是___________(写化学式),A和E形成的化合物的电子式为_____________。
(2)D、E、G、H的简单离子半径由大到小的顺序为__________________________。(用化学式表示)
(3)H的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是H的单质,且当有28mol电子转移时,常温共产生9mol气体,写出该反应的化学方程式_________________。
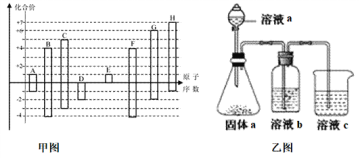
(4)由上述元素中的几种组成a、b、c各物质,某同学设计实验用乙图装置证明元素B、C、F的非金属性强弱(其中溶液b和溶液c均为足量)。
①溶液a和b分别为________,________(填化学式)。
②溶液c中的离子方程式为__________________________________________。
③请从原子结构的角度解释非金属性C>B的原因____________________。
【答案】第二周期第ⅥA族 H2O ![]() S2->Cl->O2->Na+ 4HClO4
S2->Cl->O2->Na+ 4HClO4![]() 2Cl2↑+7O2↑+2H2O HNO3 饱和NaHCO3 SiO32-+CO2+H2O=H2SiO3↓+CO32- 碳和氮两元素位于同一周期,电子层数相同,氮比碳的原子序数大,原子半径小,原子核对最外层电子的吸引能力强,所以氮比碳的非金属性强
2Cl2↑+7O2↑+2H2O HNO3 饱和NaHCO3 SiO32-+CO2+H2O=H2SiO3↓+CO32- 碳和氮两元素位于同一周期,电子层数相同,氮比碳的原子序数大,原子半径小,原子核对最外层电子的吸引能力强,所以氮比碳的非金属性强
【解析】
由图中化合价可知,A有+1、-1价,且原子序数最小,A为H;B的化合价为+4、-4价,B为C元素;C的原子序数小于O,C的化合价有+5、-3价,则C为N;D的化合价只有-2价,没有正化合价,故D为O元素;E的原子序数大于O,且E的化合价为+1价,处于ⅠA族,故E为Na元素;F、B的化合价相同,F与B位于同主族,F的原子序数大,则F为Si;G的最高正价为+6价、最低价为-2,应为S元素;H的最高正价为+7,原子序数最大,则H为Cl。
由上述分析可知:A为H、B为C、C为N、D为O、E为Na、F为Si、G为S、H为Cl,
(1)D元素为O元素,在周期表中的位置为第二周期第ⅥA族,水分子间含氢键,D和G的简单氢化物中沸点高的是H2O,A和E形成的化合物为NaH,为离子化合物,其电子式为![]() 。
。
(2)电子层数越多,离子半价越大,具有相同电子排布的离子中原子序数大的离子半径小,则离子半径为S2->Cl->O2->Na+;
(3)H的最高价氧化物对应的水化物为HClO4,浓溶液不稳定,受热可分解,产物之一是H的单质氯气,且当有28mol电子转移时,常温共产生9mol气体,H为氯气,生成2mol氯气时得到28mol电子,则由电子守恒可知还生成7mol氧气,该反应为4HClO4![]() 2Cl2↑+7O2↑+2H2O;
2Cl2↑+7O2↑+2H2O;
(4)对a、b、c三种物质,某同学设计实验用乙图装置证明元素B、C、F的非金属性强弱由图可知,锥形瓶中发生硝酸与碳酸钙的反应生成二氧化碳,溶液b可除去二氧化碳中挥发的硝酸,试剂为饱和碳酸氢钠,溶液c为硅酸钠,均发生强酸制取弱酸的反应。
①溶液a和b分别为HNO3、饱和NaHCO3。
②碳酸的酸性强于硅酸,溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-。
③从原子结构的角度解释非金属性C>B的原因为:碳和氮两元素位于同一周期,电子层数相同,氮比碳的原子序数大,原子半径小,原子核对最外层电子的吸引能力强,所以氮比碳的非金属性强。