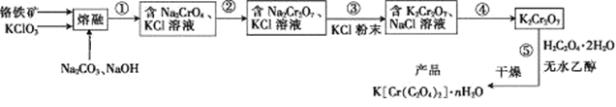
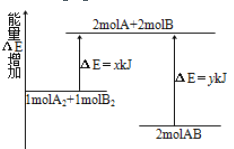
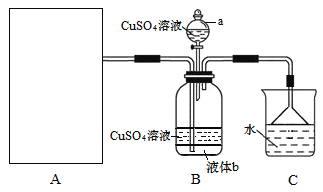
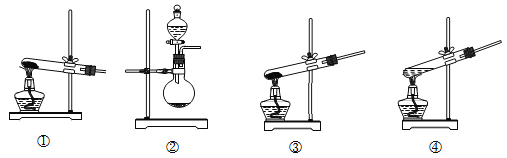
题目内容
【题目】已知反应①2F2+2H2O=4HF+O2↑;②AlCl3+3NaHCO3=Al(OH)3↓+3NaCl+3CO2↑ ;③2Na+2H2O=2NaOH+H2↑;④SO2+H2O=H2SO3⑤SO2+Cl2+2H2O=H2SO4+2HCl;⑥NaH+H2O=NaOH+H2↑;⑦CO+H2O![]() CO2+H2;⑧3NO2+H2O = 2HNO3+NO
CO2+H2;⑧3NO2+H2O = 2HNO3+NO
(1)上述反应中不属于氧化还原反应的有(填序号,下同)_____________
(2)H2O被氧化的是_____________;属于氧化还原反应,但H2O既不被氧化,也不被还原的是_____________。
(3)写出⑤的离子反应方程式_____________。
(4)用双线桥法表示反应⑧中电子转移的方向和数目,并指出氧化产物和还原产物。双线桥法:_____________;氧化产物:_____________;还原产物:_____________。
【答案】②④ ① ⑤⑧ SO2+Cl2+2H2O=4H++SO42-+2Cl-  HNO3 NO
HNO3 NO
【解析】
(1)含元素化合价变化的反应为氧化还原反应;
(2)水被氧化,则水中O元素的化合价升高,水被还原,则水中H元素的化合价降低;若水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原;
(3)根据拆写原则写出离子方程式;
(4)根据反应寻找失电子和得电子的元素的原子,双线桥即标出失电子的元素指向同种元素,得电子的元素指向同种元素,化合价升高或降低的数目就是转移的电子数,据此书写;
(1)只有②④反应中没有元素的化合价变化,不属于氧化还原反应,
故答案为:②④;
(2)只有①水中O元素的化合价升高,水被氧化;只有⑤⑧中属于氧化还原反应,但水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原,
故答案为:①;⑤⑧;
(3)⑤SO2+Cl2+2H2O=H2SO4+2HCl,硫酸和氯化氢是两种强酸,要拆成离子的形式,二氧化硫,水是氧化物写化学式,氯气是单质也要写化学式,故离子方程式是:SO2+Cl2+2H2O=4H++SO42-+2Cl-
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-
(4)该反应中,只有氮原子化合价变化,电子转移的方向和数目为 ,化合价升高对应的产物是氧化产物,即是硝酸,化合价降低对应的还原产物,即是NO,
,化合价升高对应的产物是氧化产物,即是硝酸,化合价降低对应的还原产物,即是NO,
故答案为: HNO3 ; NO ;
HNO3 ; NO ;

 阅读快车系列答案
阅读快车系列答案