题目内容
【题目】碲化钠(Na2Te)可用作有机合成试剂及缩合反应中的催化剂。以碲铅矿(主要成分为PbTe)和粗盐(含CaCl2、MgCl2及一些硫酸盐、泥沙)为原料制备碲化钠的工艺流程如下:
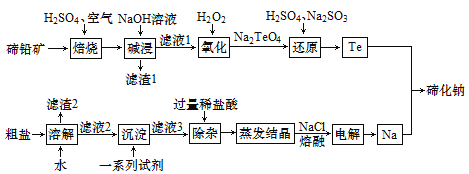
回答下列问题:
(1)Na2TeO4中Te的化合价为___。
(2)“沉淀”步骤中一系列试剂均过量,这些试剂依次包括_____(填化学式)和NaOH。
(3)“蒸发结晶”时用到的主要仪器有铁架台(带铁圈)、酒精灯、坩埚钳、_____等。
(4)已知“焙烧”后,碲主要以TeO2形式存在,“焙烧”反应的化学方程式为____。
(5)依据“氧化”“还原”两步反应可判知Na2TeO4、H2O2和Na2SO4氧化性由强到弱的顺序为___;“还原”步骤中,还原剂与氧化剂的物质的量比为_______。
(6)若制得8.7kg碲化钠,理论上电解产生标准状况下氯气的体积为______升。
【答案】+6 BaCl2、Na2CO3 蒸发皿、玻璃棒 2PbTe+3O2+2H2SO4![]() 2PbSO4+2TeO2+2H2O H2O2>Na2TeO4>Na2SO4 3:1 1120
2PbSO4+2TeO2+2H2O H2O2>Na2TeO4>Na2SO4 3:1 1120
【解析】
(1)根据化合物中所有元素化合价代数和等于0确定Te的化合价;
(2)根据粗盐中含有的杂质确定使用的沉淀试剂;
(3)根据蒸发结晶操作判断使用的仪器;
(4)“焙烧”后,碲铅矿(主要成分为PbTe)中的碲主要以TeO2形式存在,根据电子守恒、原子守恒书写反应方程式;
(5)根据氧化性:氧化剂>氧化产物比较氧化性,根据氧化还原反应的规律计算“还原”步骤中,还原剂与氧化剂的物质的量比;
(6)先计算Na2Te的物质的量,确定需要Na的物质的量,然后利用NaCl制取Na与Cl2的关系得到Cl2的物质的量,最后根据V=n·Vm计算氯气的体积。
(1)在Na2TeO4中,Na是+1价,O是-2价,由于化合物中所有元素化合价代数和等于0所以Te的化合价为+6价;
(2)在粗盐NaCl中含有杂质为Na2SO4、CaCl2、MgCl2,除去Na2SO4使用BaCl2溶液,除去CaCl2使用Na2CO3溶液,除去MgCl2使用NaOH溶液,为了将杂质除尽,加入的除杂试剂要过量,而且要容易除去,所以BaCl2溶液要在Na2CO3溶液之前使用,使原溶液中的Ca2+及加入Ba2+都转化为难溶性的碳酸盐一起除去。所以“沉淀”步骤中一系列试剂均过量,这些试剂依次包括BaCl2、Na2CO3和NaOH。
(3) 在“蒸发结晶”时用到的主要仪器有铁架台(带铁圈)、酒精灯、坩埚钳、蒸发皿、玻璃棒等。
(4) “焙烧”时碲铅矿(主要成分为PbTe)中的碲主要以TeO2形式存在,结合流程图,并根据电子守恒、原子守恒可得该反应的化学方程式:2PbTe+3O2+2H2SO4![]() 2PbSO4+2TeO2+2H2O;
2PbSO4+2TeO2+2H2O;
(5)根据流程图可知H2O2将TeO2氧化为Na2TeO4,Na2TeO4将Na2SO3氧化为Na2SO4.根据氧化还原反应的规律:氧化剂的氧化性大于氧化产物的氧化性,可知物质的氧化性有强到弱的顺序为:H2O2>Na2TeO4>Na2SO4;在还原反应中发生反应:Na2TeO4+3Na2SO3+H2SO4=Te+4Na2SO4+H2O;反应中还原剂是Na2SO3,氧化剂是Na2TeO4,二者的物质的量的比是3:1;
(6) 8.7kg碲化钠的物质的量是n(Na2Te)=8700g÷174g/mol=50mol,根据Na元素守恒可知需要Na的物质的量是50mol×2=100mol,根据方程式2NaCl(熔融)![]() 2Na+Cl2↑可知产生100molNa,会同时得到50molCl2,其在标准状况下的体积V(Cl2)= 50mol×22.4L/mol=1120L。
2Na+Cl2↑可知产生100molNa,会同时得到50molCl2,其在标准状况下的体积V(Cl2)= 50mol×22.4L/mol=1120L。

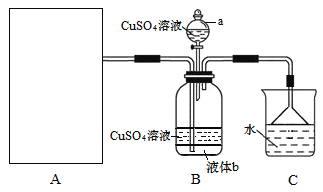
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
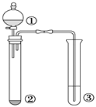
选项 | ① | ② | ③ | 实验结论 |
A | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 氯气具有酸性、漂白性 |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:N>C>Si |
A. AB. BC. CD. D