题目内容
15.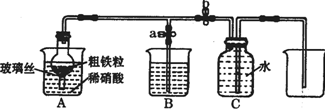 (1)如图所示是实验室中制取气体的一种简易装置.
(1)如图所示是实验室中制取气体的一种简易装置.①请简述检验它的发生装置气密性的方法关闭止水夹a和b,从A处加入水,使干燥管内外形成液面差,一段时间后,液面差没有变化,说明气密性良好.
②利用图所示装置可以制取块状或较大颗粒状固体与液体不需要加热反应生成气体(填反应
物状况及发生反应是否需要的条件).
(2)张明同学设计图所示装置,用粗铁粒与189g•L-1硝酸反应制取NO气体.请回答有关问题.
①189g•L-1硝酸的物质的量浓度为3mol•L-1.
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应;NO与空气密度接近.
③当打开末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
④该实验中,若去掉B装置,对实验结果是否有影响?无影响.
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(用含a和b的代数式表示).
⑥完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管、0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
分析 (1)①检验装置的气密性,使密闭容器内形成液面差即可;
②此装置是固体与液体不加热制取气体装置,据此解答即可;
(2)①硝酸的物质的量浓度c=$\frac{n}{V}=\frac{\frac{m}{M}}{V}$;
②一氧化氮的性质:极易和空气中的O2反应,与空气密度接近;
③铁和稀硝酸反应生成一氧化氮,一氧化氮会迅速被氧化为二氧化氮,二氧化氮有毒;
④二氧化氮和水反应产物是一氧化氮;
⑤根据氧化还原反应中得失电子数目相等来回答;
⑥铁和硝酸反应的产物取决于铁的量的多少,亚铁离子具有还原性,能使高锰酸钾褪色,三价铁遇KSCN溶液显红色.
解答 解:(1)①关闭止水夹a和b,从A处烧杯中加入水,干燥管与烧杯中液面能形成液面差,所以能检验装置的气密性,故答案为:关闭止水夹a和b,从A处加入水,使干燥管内外形成液面差,一段时间后,液面差没有变化,说明气密性良好;
②此装置是固体与液体不加热制取气体装置,固体采用块状或颗粒较大的固体,如大理石与稀盐酸制取二氧化碳气体,故答案为:块状或较大颗粒状固体与液体不需要加热反应生成;
(2)①硝酸的物质的量浓度c=$\frac{n}{V}=\frac{\frac{m}{M}}{V}=\frac{\frac{189g}{63g/mol}}{1L}$=3mol•L-1,故答案为:3mol•L-1;
②一氧化氮的性质:极易和空气中的O2反应,与空气密度接近,所以不能用排空气法,故答案为:NO与空气中的O2反应,NO与空气密度接近;
③铁和稀硝酸反应生成一氧化氮,一氧化氮会迅速被氧化为二氧化氮,所以A装置的干燥管中观察到的现象是:有红棕色气体出现,二氧化氮有毒,属于酸性气体,可以用烧碱溶液吸收,故答案为:有红棕色气体出现;吸收NO2;
④二氧化氮和水反应产物是一氧化氮,所以若去掉B装置,对收集一氧化氮不会产生影响,故答案为:无影响;
⑤氧化还原反应中得失电子数目相等,Fe和HNO3均无剩余,金属铁全转化为亚铁,铁失电子的量为2amol,金属铁全转化为三价铁,铁失电子的量为3amol,金属铁的生成物既有亚铁离子又有三价铁离子是,铁失电子的量就2a~3amol之间,硝酸显示酸性和氧化性,显示酸性的硝酸和表现氧化性的硝酸的物质的量之比均为3:1,此时硝酸的转移电子的量为$\frac{3b}{4}$mol,故答案为:$\frac{3b}{4}$mol;
⑥铁相对于硝酸过量时,产物只有亚铁离子,亚铁离子具有还原性,能使高锰酸钾褪色,弱硝酸相对于硝酸不足时,产物只有三价铁离子,三价铁遇KSCN溶液显红色,有可能铁的两种价态均存在,故答案为:+2价或+3价或+2价和+3价;
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | 若溶液变血红色,说明含Fe3+,若溶液无明显变化,说明不含Fe3+ |
| 第二步 | 取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液 | 若溶液紫色退去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
点评 本题是一道有关气体性质的大型综合题,题目综合性较强,难度较大,涉及实验装置气密性检查、实验方案的设计与评价.

 名校课堂系列答案
名校课堂系列答案| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物不能分解 | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 这种化合物可以由PH3和HI化合而成 |
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为 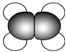 ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成. ②球棍模型为 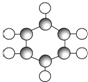 |
| C | ①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成乙酸乙酯 |
| D | ①由C与HCl浓溶液取代反应生成; ②在不同条件下,D能生成A,也能生成C |
| E | ①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
(1)A~E中,属于烃的是AB(填字母).
(2)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应.
(4)写出D生成A的化学方程式CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O反应类型为消去反应.
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O(用化学方程式说明).
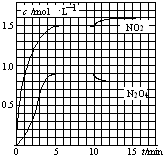 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
| A. | 前5min反应的平均速率v(N2O4)=0.36mol•(L•min)-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 反应①、②均为吸热反应 | |
| D. | 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
| A. | 乙醇 | B. | 苯酚溶液 | C. | 直馏汽油 | D. | 乙酸 |
| A. | 分散质颗粒的大小在1-100 nm之间 | B. | 有丁达尔现象 | ||
| C. | 是均一、透明的液体 | D. | 能够稳定存在 |
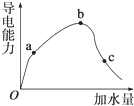 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: