题目内容
17. 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.请回答下列问题:
(1)TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl.
(2)检验TiO2•xH2O中Cl-是否被除净的方法是取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净.
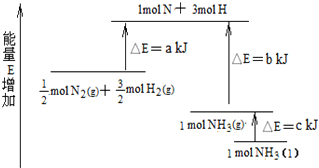
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是抑制NH4Fe(SO4)2水解;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要图中的ac(填字母代号).
(4)滴定终点的现象是溶液变为红色.
(5)滴定分析时,称取TiO2(摩尔质量为M g•mol-1)试样W g,消耗c mol•L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为$\frac{CVM}{1000w}$×100%.
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果偏低.
分析 (1)TiCl4水解生成TiO2•xH2O和氯化氢,根据物质的性质和质量守恒定律书写化学方程式;
(2)检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在氯离子;
(3)铁离子水解易使配制溶液变浑浊,应加对应酸抑制水解,依据配制溶液实验过程和步骤分析,需要的仪器一定使用容量瓶和胶头滴管;
(4)用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+,铁离子变化为亚铁离子,因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,滴入最后一滴会生成血红色的Fe(SCN)3;
(5)根据得失电子守恒,有:1Ti3+~1Fe3+,故n(Fe3+)=n(Ti3+)=n(TiO2)=cV×10-3mol,据此计算其质量分数为;
(6)①NH4Fe(SO4)2溶液溅出,其物质的量浓度减小,消耗的体积增大,百分含量偏大;
②若终点俯视滴定管,读取的体积比实际消耗的体积偏小,质量分数偏小.
解答 解:(1)设TiCl4的系数为1,根据元素守恒,TiO2•xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),反应为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl;
故答案为:TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl;
(2)沉淀吸附溶液中的Cl-,根据发生反应:Cl-+Ag+═AgCl↓,取少量洗涤液,检验溶液中溶解的离子是否还存在;
故答案为:取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净;
(3)铁离子水解易使配制溶液变浑浊,应加对应酸抑制水解应抑制水解,不引入杂质,所以加硫酸抑制NH4Fe(SO4)2水解,配制溶液用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需容量瓶和胶头滴管,故选ac;
故答案为:抑制NH4Fe(SO4)2水解;ac;
(4)Fe3+与Ti3+反应,被还原为Fe2+,加入KSCN不显红色,当达到滴定终点时,再加入NH4Fe(SO4)2,溶液中Fe3+过量,所以滴入最后一滴NH4Fe(SO4)2,溶液会生成血红色的Fe(SCN)3,溶液会变成红色;
故答案为:溶液变为红色;
(5)根据得失电子守恒,有:1Ti3+~1Fe3+,故n(Fe3+)=n(Ti3+)=n(TiO2)=cV×10-3mol,其质量分数=$\frac{CV×1{0}^{-3}mol×Mg/mol}{wg}$×100%=$\frac{CVM}{1000w}$×100%;
故答案为:$\frac{CVM}{1000w}$×100%;
(6)①NH4Fe(SO4)2溶液溅出,其物质的量浓度减小,消耗的体积增大,则测定结果中百分含量偏高,故答案为:偏高;
②若终点俯视滴定管,读取的体积比实际消耗的体积偏小,质量分数偏小,故答案为:偏低.
点评 本题考查物质含量的探究性实验,涉及基本操作、离子检验和氧化还原滴定等,把握水解原理、氧化还原滴定法原理为解答的关键,侧重分析能力及迁移应用能力的考查,注意对实验原理的理解与对基本操作的掌握,题目难度中等.

 智慧小复习系列答案
智慧小复习系列答案| A. | CH3CH2CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3COOH和HCOOCH3 | D. | CH3CH2CHO和CH3COCH3 |
| A. | NH3分子是非极性分子 | |
| B. | 分子内3个N-H键的键长相等,键角相等 | |
| C. | NH3分子内3个N-H键的键长相等,3个键角都等于107°18′ | |
| D. | NH3分子内3个N-H键的键长相等,3个键角都等于120° |

,下列有关叙述中不正确的是( )
| A. | 它易溶于有机溶剂 | |
| B. | 可与NaOH和Na2CO3溶液发生反应 | |
| C. | 该有机物分子中一定有14个碳原子共平面 | |
| D. | 1 mol该有机物可与5 mol Br2发生反应 |
| A. | Cl2 | B. | NH4Cl | C. | HCl | D. | NaOH |
| A. | R(OH)3 | B. | R2O7 | C. | HRO3 | D. | H2R |
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物不能分解 | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 这种化合物可以由PH3和HI化合而成 |
| A. | 乙醇 | B. | 苯酚溶液 | C. | 直馏汽油 | D. | 乙酸 |