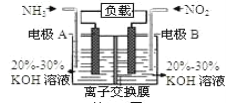
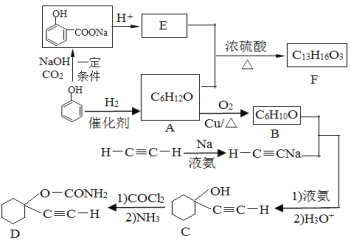
题目内容
【题目】已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是

A. a点表示溶液中c(H+)=10-3 mol/L
B. b点表示的溶液中c(CH3COO-)>c(Na+)
C. c点表示CH3COOH和NaOH恰好反应完全
D. a、b点表示的溶液中c(CH3COO-).c(H+)/c(CH3COOH)均等于K
【答案】C
【解析】
A.酸能抑制水的电离,再根据弱电解质的性质分析溶液中醋酸根离子的浓度;
B.从溶液电中性的角度分析;
C.根据醋酸和氢氧化钠生成盐的类型判断恰好反应时溶液的酸碱性,从而确定该选项是否正确;
D.电离平衡常数只与温度有关,与其它任何条件都无关。
A.由图中信息可知,a点pH=3,故c(H+)=10-3mol/L,A正确;
B.由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),b点溶液pH<7,c(H+)>c(OH-),则有c(CH3COO-)>c(Na+),故B正确;
C.醋酸和氢氧化钠反应生成醋酸钠,醋酸钠是强碱弱酸盐其水溶液呈碱性,当酸碱恰好反应时溶液应该呈碱性,但C点溶液呈中性,说明酸过量,故C错误;
D.a、b两点溶液的温度相同,弱电解质的电离常数只与温度有关,所以a、b点表示的溶液中c(CH3COO-)c(H+)/c(CH3COOH)均等于醋酸的电离常数K,故D正确。
故选C。

 考前必练系列答案
考前必练系列答案【题目】一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g)![]() 2N2O5(g);已知该反应的平衡常数:K300℃>K350℃,且体系中n(NO2)(单位:mol)随时间变化如下表:
2N2O5(g);已知该反应的平衡常数:K300℃>K350℃,且体系中n(NO2)(单位:mol)随时间变化如下表:
时间(s) | 0 | 500 | 1000 | 1500 |
t1℃ | 20 | 13.96 | 10.08 | 10.08 |
t2℃ | 20 | a | b | c |
下列说法一定正确的是
A. 正反应为吸热反应
B. 如果t2℃<t1℃,那么a>b=c,且a=10+0.5b
C. 如果t2℃<t1℃,那么t2℃达到平衡的时间介于1000s至1500s之间
D. 如果t2℃>t1℃,那么b>10.08