题目内容
【题目】原子序数由小到大排列的四种短周期主族元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式:__,其中含有的化学键是__。
(2)将ZO2通入品红溶液再加热的现象是__。
(3)写出X的最高价氧化物对应的水化物的稀溶液与铜反应的化学方程式__。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是_(填化学式)。
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式__。
【答案】![]() 离子键、共价键 品红先褪色,加热后恢复红色 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O NH3 NCl3+3H2O=3HClO+NH3
离子键、共价键 品红先褪色,加热后恢复红色 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O NH3 NCl3+3H2O=3HClO+NH3
【解析】
原子序数由小到大排列的四种短周期元素X、Y、Z、W,Y与氧元素可组成Y2O和Y2O2的离子化合物,Y为Na(因原子序数关系,Y不可能为H),其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物,可知X为N,Z为S,W为Cl,以此解答。
由上述分析可知,X为N,Y为Na,Z为S,W为Cl,
(1)Na2O2为Na+与![]() 组成的离子化合物,
组成的离子化合物,![]() 中含有共价键,以此Na2O2的电子式为:
中含有共价键,以此Na2O2的电子式为:![]() ;所含化学键为:离子键、共价键;
;所含化学键为:离子键、共价键;
(2)SO2具有漂白性,能够漂白品红溶液,但其漂白过程具有可逆性,若加热漂白后的品红溶液,则溶液恢复至红色,故答案为:品红先褪色,加热后恢复红色;
(3)稀硝酸与铜反应生成硝酸铜、一氧化氮、水,其化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(4)NH3为碱性气体,H2S、HCl为酸性气体,NH3能够与H2S、HCl发生化学反应;
(5)N原子最外层电子数为5,Cl原子最外层电子数为7,由N、Cl组成的化合物分子中,N、Cl原子的最外层均达到8电子稳定结构,则该化合物为NCl3,其中N为-3价,Cl为+1价,NCl3与水反应生成一种具有漂白性的化合物,该化合物为HClO,其反应方程式为:NCl3+3H2O=3HClO+NH3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
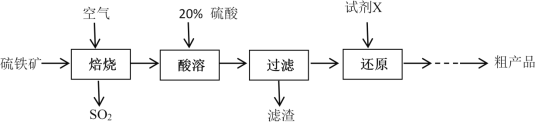
小学生10分钟应用题系列答案【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:

已知:i.部分离子完全生成氢氧化物沉淀的pH
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为___________。
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_______(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,其中过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为______,阳极的电极反应式为______________________。
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是_____________________________。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH >7,该溶液中离子浓度从大到小的排列为________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01 mol·L-1,则溶液中CO32-物质的量浓度应 ≥ ______________。