题目内容
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
【答案】C
【解析】
分析装置的特点,可知左边是燃料电池,右边是电解池;通入氧气的电极甲是电池的正极,与甲相连的电极丁是电解池的阳极,则丁电极上MnO42―被氧化为MnO4-;丙电极是电解池的阴极,溶液中氢离子在阴极被还原为氢气,所以气体X是氢气。
A、通入氧气的电极为电池的正极,与电源正极相连的一极为电解池阳极,所以丙是阴极,故A正确;
B、丁是电解池阳极,MnO42―失电子被氧化为MnO4-,电极反应式是MnO42――e-===MnO4-,故B正确;
C、丙电极上的反应是![]() ,电极甲的电极反应式是
,电极甲的电极反应式是![]() ,乙电极的电极反应式为H2-2e-+2OH-=2H2O,根据溶液流动方向,c%>b%>a%,故C错误,
,乙电极的电极反应式为H2-2e-+2OH-=2H2O,根据溶液流动方向,c%>b%>a%,故C错误,
D. 标准状况下,甲电极上每消耗22.4L氧气时,转移4mol电子,所以理论上有4molK+移入阴极区,故D正确。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>____________。基态K+电子占据最高能级的电子云轮廓图为________形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______,中心原子的杂化形式为_______。NaBH4中存在_____(填标号)。
a. 离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为________,其中Be的配位数为_______。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:_____________________。
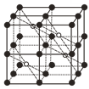
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,其空隙率是________。若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=_________ g·cm-3(列出计算表达式)。
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | — | 315 | — |
熔点/℃ | -70.0 | — | — | — |
升华温度/℃ | — | 180 | 300 | 162 |
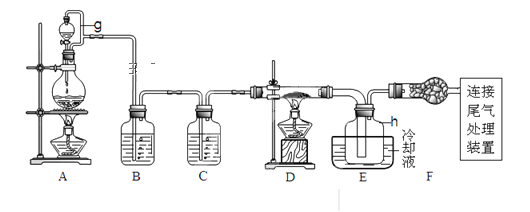
请回答下列问题:
(1)写出装置A中发生反应的离子方程式___。
(2)装置A中g管的作用是___;装置C中的试剂是___;装置E中的h瓶需要冷却理由是___。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质。为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+。
①写出用KMnO4滴定Fe2+的离子方程式:___;
②滴定前是否要滴加指示剂?___(填“是”或“否”),判断滴定终点的方法是___。
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是___。