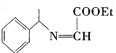
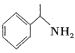
题目内容
【题目】在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
A. 0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
B. 当容器中混合气体密度不变时达到平衡状态
C. 平衡后升高温度,X的反应速率降低
D. 到达平衡状态时,反应放出的热量为a kJ
【答案】A
【解析】
A.v(M)=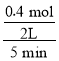 =0.04molL-1min-1,相同时间内同一反应中不同物质的反应速率之比等于其计量数之比,0~5min,Y平均反应速率=2v(M)=2×0.04molL-1min-1=0.08molL-1min-1,故A正确;
=0.04molL-1min-1,相同时间内同一反应中不同物质的反应速率之比等于其计量数之比,0~5min,Y平均反应速率=2v(M)=2×0.04molL-1min-1=0.08molL-1min-1,故A正确;
B.该反应过程中容器的体积不变,气体的质量不变,因此气体的密度始终不变,容器中混合气体密度不变,不能说明达到平衡状态,故B错误;
C.升高温度,活化分子百分数增大,所以正逆反应速率都增大,故C错误;
D.该反应为可逆反应,所以X、Y不能完全转化为生成物,达到平衡状态时X消耗的物质的量小于1mol,所以放出的热量小于akJ,故D错误;
答案选A。

【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=____kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是___(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)% =___%。
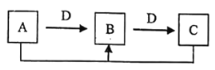
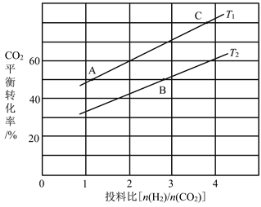
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____;KA、KB、KC三者之间的大小关系为____。
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%
×100%
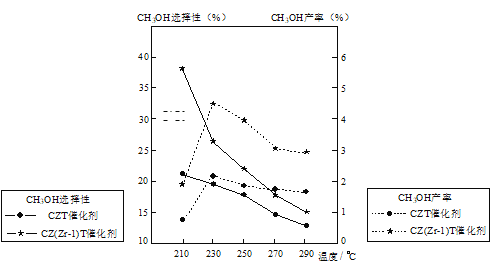
①温度高于230℃,CH3OH产率随温度升高而下降的原因是_____。
②在上述条件下合成甲醇的工业条件是____。
p>A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T【题目】下列实验操作不能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 比较金属镁和铝的活泼性 | 分別向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象 |
B | 除去Mg粉中混有的Al 粉 | 加入足量的NaOH 溶液,过滤、洗涤、干燥 |
C | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
D | 配制0.4000mol·L1的NaOH溶液 | 称取4.0g固体NaOH于烧杯中,直接向烧杯中加入250mL水 |
A. AB. BC. CD. D