题目内容
【题目】下列离子方程式表达正确的是
A.钠与水反应:2Na+H2O=2Na++OH-+H2↑
B.NO2溶于水:3NO2+H2O=2H++2![]() +NO
+NO
C.向氢氧化钡溶液中滴加稀硫酸:Ba2++![]() +OH-+H+=BaSO4↓+H2O
+OH-+H+=BaSO4↓+H2O
D.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=![]() +4
+4![]() +2H2O
+2H2O
【答案】B
【解析】
A.钠与水反应生成氢氧化钠和氢气,离子反应方程式为2Na+2H2O=2Na++2OH-+H2↑,A错误;
B.NO2溶于水反应生成硝酸和一氧化氮,硝酸为强酸,离子方程式为3NO2+H2O=2H++2![]() +NO,B正确;
+NO,B正确;
C.向氢氧化钡溶液中滴加稀硫酸反应生成硫酸钡和水,离子方程式为Ba2++![]() +2OH-+2H+=BaSO4↓+2H2O ,C错误;
+2OH-+2H+=BaSO4↓+2H2O ,C错误;
D.向AlCl3溶液中加入过量氨水反应生成氢氧化铝沉淀和氯化铵,离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3![]() ,D错误;
,D错误;
答案选B。

 心算口算巧算一课一练系列答案
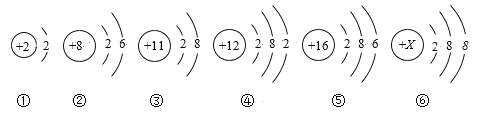
心算口算巧算一课一练系列答案【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第____周期第__族,它的一种核素可测定文物年代,这种核素的符号是____。
(2)元素Y的原子结构示意图为___,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法_____。
(3)元素Z与元素T相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____,理由______。
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作 | 结论 |
A | 向甲苯中滴加少量高锰酸钾溶液,高锰酸钾溶液褪色 | 甲苯发生了氧化反应 |
B | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀生成 | 蛋白质发生了变性 |
C | 向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀 | 该溶液中含有 |
D | 向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入新制的Cu(OH)2悬浊液,加热,没有观察到砖红色沉淀 | 淀粉没有水解 |
A.AB.BC.CD.D
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=________,已知:K(300℃)>K(350℃),该反应是________反应(填“放热”或“吸热”)。
(2)下图中表示NO2的变化的曲线是___,用O2的浓度变化表示从0~2 s内该反应的平均速率v=__________。

(3)能说明该反应已经达到平衡状态的是(____)
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是(____)
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂