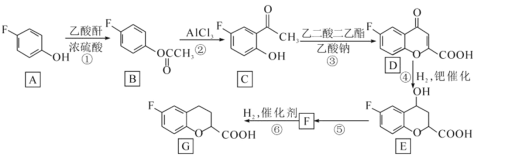
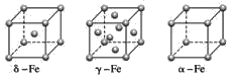
题目内容
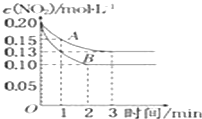
【题目】有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g)![]() N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
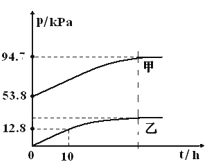
①上图中表示O2压强变化的曲线是_________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率υ=0.12pN2O5(kPah-1),t=10h时,pN2O5=___kPa,υ=_________kPah-1(结果保留两位小数,下同)。
③该温度下2NO2![]() N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
【答案】乙 28.2 3.38 0.05
【解析】
①根据最开始氧气的压强得出。
②根据氧气压强求算改变的压强,再根据起始压强求分解到10h时的压强,再根据速率公式计算。
③根据三段式计算,再求平衡时压强平衡常数。
①根据反应分析,随着反应的进行氧气的压强从0开始逐渐增大,所以乙为氧气的压强曲线,故答案为:乙。
②t=10h时,pO2=12.8 kPa ,2N2O5(g) = 4NO2(g)+O2(g)分析,反应的五氧化二氮的分压为25.6 kPa ,起始压强为53.8 kPa,所以10h时pN2O5=53.8kPa-25.6 kPa=28.2 kPa ,N2O5 分解的反应速率υ=0.12pN2O5(kPah-1)= 0.12×28.2= 3.38 kPah-1,故答案为:28.2;3.38。
③2N2O5(g) = 4NO2(g)+O2(g),
53.8kPa 0 0
53.8kPa 107.6kPa 26.9kPa
0 107.6kPa 26.9kPa
2NO2![]() N2O4
N2O4
起始分压107.6kPa 0
改变分压2x x
平衡分压107.6kPa-2x x
有107.6kPa-2x+x+26.9kPa=94.7 ,解x=39.8 kPa,平衡常数Kp=![]() =0.05kPa-1,故答案为:0.05。
=0.05kPa-1,故答案为:0.05。