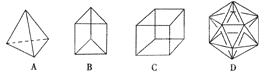
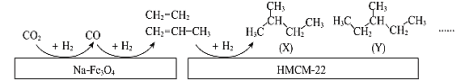
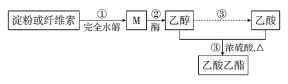
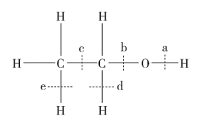
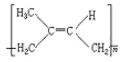
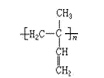
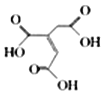
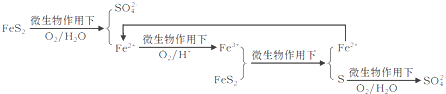
题目内容
【题目】按要求回答下列问题:
(1)黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是2Cu2O+Cu2S![]() 6Cu+SO2↑。则29Cu的外围电子轨道表示式为____;比较Cu2O与Cu2S,熔点较高的是____,原因为____。
6Cu+SO2↑。则29Cu的外围电子轨道表示式为____;比较Cu2O与Cu2S,熔点较高的是____,原因为____。
(2)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为____;该晶体中原子之间的作用力是____。
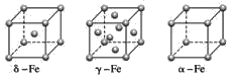
(3)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似(如图),该晶体储氢后的化学式应为____。
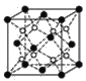
(4)铁有δ、γ、α三种同素异形体(如图),γ晶体晶胞中所含有的铁原子数为____,δ、α两种晶胞中铁原子的配位数之比为____。
【答案】![]() Cu2O S2-的半径大于O2-的半径,Cu2O键能大于Cu2S的键能,Cu2O晶格能大,因此Cu2S的沸点低于Cu2O; 3:1 金属键 H8AuCu3 4 4:3
Cu2O S2-的半径大于O2-的半径,Cu2O键能大于Cu2S的键能,Cu2O晶格能大,因此Cu2S的沸点低于Cu2O; 3:1 金属键 H8AuCu3 4 4:3
【解析】
⑴Cu位于第四周期IB族,29号元素,因此其电子排布式为1s22s22p63s23p63d104s1,29Cu的外围电子排布式为3d104s1,其外围电子轨道表示式为![]() ,Cu2O和Cu2S都属于离子晶体,晶格能越大,晶体熔沸点越高,晶格能与半径、所带电荷数有关,半径越小、所带电荷数越多,晶格能越大,Cu2O和Cu2S所带电荷数相同,S2-的半径大于O2-的半径,因此Cu2S的沸点低于Cu2O;
,Cu2O和Cu2S都属于离子晶体,晶格能越大,晶体熔沸点越高,晶格能与半径、所带电荷数有关,半径越小、所带电荷数越多,晶格能越大,Cu2O和Cu2S所带电荷数相同,S2-的半径大于O2-的半径,因此Cu2S的沸点低于Cu2O;
故答案为:![]() ;Cu2O;S2-的半径大于O2-的半径,Cu2O键能大于Cu2S的键能,Cu2O晶格能大,因此Cu2S的沸点低于Cu2O;
;Cu2O;S2-的半径大于O2-的半径,Cu2O键能大于Cu2S的键能,Cu2O晶格能大,因此Cu2S的沸点低于Cu2O;
⑵一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,即6×![]() =3,Au原子处于顶点,即8×
=3,Au原子处于顶点,即8×![]() =1,因此合金中Cu原子与Au原子数量之比为3:1,该晶体为金属晶体,因此原子之间的作用力是金属键,
=1,因此合金中Cu原子与Au原子数量之比为3:1,该晶体为金属晶体,因此原子之间的作用力是金属键,
故答案为:3:1;金属键;
⑶氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,因此根据图中信息得出氢原子共有8个,因此该晶体储氢后的化学式应为H8AuCu3,
故答案为:H8AuCu3;
⑷γ晶体晶胞中是面心晶胞,所含有的铁原子数为![]() ,δ是体心立方,配位数为8,α是简单立方,配位数为6,因此两种晶胞中铁原子的配位数之比为4:3,
,δ是体心立方,配位数为8,α是简单立方,配位数为6,因此两种晶胞中铁原子的配位数之比为4:3,
故答案为4;4:3。

【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
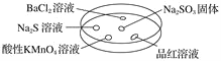
下表中对实验现象的描述或所做的解释不正确的是( )
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
【题目】化学中很多规律![]() 性质
性质![]() 都有其适用范围,下列根据其推出的结论正确的是( )
都有其适用范围,下列根据其推出的结论正确的是( )
选项 | 规律 | 结论 |
A | 主族元素最高正化合价等于族序数 | 第ⅦA族元素最高正价都是+7 |
B | SO2和湿润的 | 二者混合后漂白性更强 |
C | 常温下铜与浓硝酸反应可以制取 | 常温下铁与浓硝酸反应也可以制取 |
D | 较强酸可以制取较弱酸 |
|
A.AB.BC.CD.D