题目内容
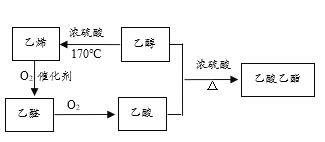
【题目】根据如下物质的转化关系图,回答有关问题:
(1)上述物质中,_________(填结构简式,下同)的产量是衡量一个国家石油化工发展水平的标志;常见的酸性调味品中含有3%~5%的_________;具有香味的油状液体是_____________。
(2)乙醇中![]() 官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
(3)生成乙酸乙酯的化学方程式是__________________________。
【答案】CH2=CH2 CH3COOH CH3COOC2H5 羟基 CH3OH CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
【解析】
乙烯氧化生成是乙醛,乙醛氧化生成乙酸,乙醇与乙酸反应生成乙酸乙酯,乙醇发生消去反应生成乙烯。
(1)乙烯的产量是衡量一个国家石油化工发展水平的标志;常见的酸性调味品中含有3%~5%的醋酸,具有香味的油状液体是乙酸乙酯,
故答案为: CH2=CH2 ;CH3COOH ; CH3COOC2H5
(2)乙醇中![]() 官能团名称是羟基,比乙醇少一个碳原子的同系物的结构简式是甲醇,
官能团名称是羟基,比乙醇少一个碳原子的同系物的结构简式是甲醇,
故答案为: 羟基 ; CH3OH
(3)乙醇与乙酸反应生成乙酸乙酯和水,化学方程式是:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O,
CH3COOCH2CH3 + H2O,
故答案为:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目