题目内容
【题目】R、X、Y、Z是周期表前四周期元素,原子序数依次增大。R是宇宙中含量最多的元素,X、Y、Z三种元素的基态原子内层所有能级均已填满电子。X元素的基态原子的核外电子分布在三个能级上,且每个能级上排布了相同的电子数。Y与X同周期,且Y与X的基态原子中未成对电子数相同。Z的周期数比X的周期数多2,Z的基态原子最外层只有1个电子。回答下列问题:
(1)Z元素的价电子排布式为____________。
(2)R2Y可与Z的正二价离子形成一种复杂离子[Z(R2Y)4]2+,[Z(R2Y)4]2+的几何构型是______;将[Z(R2Y)4]2+与硫酸根形成的盐溶液装入试管中,逐滴加入氨水直至过量,出现的实验现象是______________。
(3)X与R可形成一种化学式为X3R4的不稳定化合物,是一种话性中间体,X3R4分子中3个X原子成直线排列,中间的X原子的杂化轨道类型为_____杂化。当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子___(填“具有“或”不具有”)手性。
(4)下列排列方式中,通常条件下Z的晶体的堆积方式是______(填序号)。Z的晶体中,Z原子的配位数为________。
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
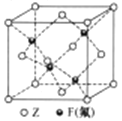
(5)Z与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则Z与F(氟)最近距离为______pm(阿伏加德罗常数用NA表示,列出计算表达式,不用化简,1pm=1.0×10-12m)。
【答案】 3d104s1 平面四边形(或正方形) 首先形成蓝色沉淀,继续添加氨水,沉淀溶解。得到深蓝色透明溶液 sp 具有 a 12 ![]()
【解析】R、X、Y、Z是周期表前四周期元素,原子序数依次增大。R是宇宙中含量最多的元素氢元素,X、Y、Z三种元素的基态原子内层所有能级均已填满电子。X元素的基态原子的核外电子分布在三个能级上,且每个能级上排布了相同的电子数则电子排布式为1s22s22p2,为C 元素。Y与X同周期,且Y与X的基态原子中未成对电子数相同,则Y的电子排布式为1s22s22p4,即为氧元素。Z的周期数比X的周期数多2,Z的基态原子最外层只有1个电子则为铜元素。(1)Z为29号铜元素,价电子排布式为3d104s1;(2)R2Y即H2O,可与Z的正二价离子Cu2+形成一种复杂离子[Cu (H2O)4]2+,[Cu (H2O)4]2+铜离子核外电子排布式为1s22s22p63s23p63d9,[Cu(H2O)4]2+中心Cu2+离子是sp3d2杂化,是平面正方形;将[Cu (H2O)4]2+与硫酸根形成的盐溶液装入试管中,逐滴加入氨水直至过量,出现的实验现象是首先形成蓝色沉淀,继续添加氨水,沉淀溶解。得到深蓝色透明溶液;(3)X与R可形成一种化学式为C3H4的不稳定化合物,是一种活性中间体,C3H4分子中3个C原子成直线排列则为HC![]() C-CH3,中间的C碳原子价层电子对个数=σ键个数+孤电子对个数=2+
C-CH3,中间的C碳原子价层电子对个数=σ键个数+孤电子对个数=2+![]() ×(4-2×2)=2,采取sp杂化;当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子具有手性;(4)Cu的晶体的堆积方式是面心立方最密堆积,答案选A;Cu的晶体中,Cu原子的配位数为12;(5)根据均摊法可知,每个晶胞中含有8×
×(4-2×2)=2,采取sp杂化;当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子具有手性;(4)Cu的晶体的堆积方式是面心立方最密堆积,答案选A;Cu的晶体中,Cu原子的配位数为12;(5)根据均摊法可知,每个晶胞中含有8×![]() +6×
+6×![]() =4个铜原子,4个氟原子,Cu与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则晶胞边长为x,体积为x3,Z与F(氟)最近距离为
=4个铜原子,4个氟原子,Cu与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则晶胞边长为x,体积为x3,Z与F(氟)最近距离为![]() cm,
cm,![]() =a,解得x=
=a,解得x=![]() cm,Z与F(氟)最近距离为
cm,Z与F(氟)最近距离为![]() cm=
cm=![]() ×1010pm。
×1010pm。