题目内容
15.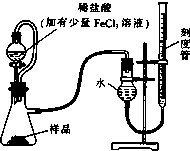 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.(1)某研究小组拟用右图装置测定一定质量的样品中过氧化镁的含量.
①实验前需进行的操作是检查装置的气密性,稀盐酸中加入少量FeCl3溶液的作用是用作催化剂(或催化H2O2的分解).
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下;消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下.
③实验终了时,待恢复至室温,先将右侧刻度管缓缓向下移动直到两侧液面相平,再平视刻度线读数.
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取ag样品,加入足量稀盐酸,充分反应后再加入NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到bg固体.
已知常温下Ksp[Mg(OH)2]=l×10-11.为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l×10-5mol/L],溶液的pH至少应调至11.
方案Ⅱ:用电子天平称取0.1000g样品置于锥形瓶中,加入15mL0.6mol/LKI溶液和足量盐酸,摇匀后在暗处静置5min,加入少量淀粉溶液作指示剂;然后用碱式滴定管盛装0.1000mol/L Na2S2O3溶液进行滴定.(已知:I2+2Na2S2O3═Na2S4O6+2NaI)
分析 (1)①实验前需进行的操作是检查装置的气密性;通过测量双氧水分解生成的氧气,可检测过氧化镁的含量,而氯化铁能作催化剂加快双氧水的分解,加快反应速率;
②气体的体积受温度和压强影响大,所以用恒压分液漏斗的优点还有消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下;
③应该将右侧刻度管缓缓向下移动直到两侧液面相平,然后再平视刻度线读数;
(2)方案I根据氢氧化镁的溶度积,计算出溶液中氢氧根离子的浓度,求出溶液的PH;
方案Ⅱ由于碘遇淀粉显蓝色,加入少量淀粉溶液作指示剂;根据电子守恒找出关系式,计算出过氧化镁的质量分数.
解答 解:(1)①实验装置连接好以后,实验前需进行的操作是检查装置的气密性;过氧化镁溶于水生成双氧水,双氧水易分解,通过测量双氧水分解生成的氧气,可检测过氧化镁的含量,而氯化铁能作催化剂加快双氧水的分解,加快反应速率,
故答案为:检查装置的气密性;用作催化剂(或催化H2O2的分解);
②由于气体的体积受温度和压强影响大,所以用恒压分液漏斗的优点还有消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下,
故答案为:消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下;
③由于气体大体积受压强影响大,所以在读数之前,应该将右侧刻度管缓缓向下移动直到两侧液面相平,然后再平视刻度线读数,
故答案为:将右侧刻度管缓缓向下移动直到两侧液面相平;
(2)方案I根据氢氧化镁的溶度积常数可知,当溶液中c(Mg2+)=l×10-5mol/L时,Ksp[Mg(OH)2]=1×10-11=c(Mg2+)•c2(OH-),溶液中OH-浓度等于1×10-3mol/L,所以溶液的pH=11;
故答案是:11;
方案Ⅱ:过氧化镁具有氧化性,能把碘化钾氧化生成单质碘,然后利用硫代硫酸钠滴定生成的单质碘即可,由于碘遇淀粉显蓝色,加入少量淀粉溶液作指示剂,Na2S2O3溶液水解呈碱性应盛放在碱式滴定管;
故答案为:淀粉溶液,碱;
点评 本题考查了学生规范严谨的实验设计、操作能力;该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力,该题是高考中的常见题型,属于中等难度的试题,试题综合性强.

 巧学巧练系列答案
巧学巧练系列答案| A. | 含氧的化合物一定是氧化物 | B. | 酸根中不一定含有氧元素 | ||
| C. | 盐的组成中一定含有金属元素 | D. | 酸中一定不含金属元素 |
| A. | 所得的分散系属于悬浊液 | |
| B. | 所得的分散系中分散质为Fe2O3 | |
| C. | 该分散系能产生丁达尔效应 | |
| D. | 该磁流体就是Fe(OH)2和Fe(OH)3的悬浊液 |
| A. | 光气(COCl2) | B. | 六氟化硫(SF6) | C. | 三氟化硼(BF3) | D. | 五氯化磷(PCl5) |
| A. | 鸡蛋白溶液中加入食盐变浑浊 | B. | 用氯化汞消毒医疗器械 | ||
| C. | 用波尔多液杀菌 | D. | 用福尔马林对种子消毒 |

