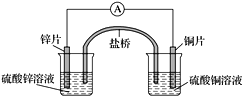
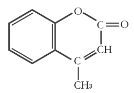
题目内容
【题目】下列说法不正确的是( )
A.石油裂化可以提高汽油等轻质油的产量和质量
B.分子式为C5H12的同分异构体共有3种
C.向2mL碘水中加入1mL苯,振荡后静置,可观察到液体分层,上层呈紫红色
D.煤中含有苯和甲苯,可用干馏的方法将它们分离开来
【答案】D
【解析】
A.石油裂化的目的为了提高轻质液体燃料![]() 汽油,煤油,柴油等
汽油,煤油,柴油等![]() 的产量,特别是提高汽油的产量,与题意不符,A错误;
的产量,特别是提高汽油的产量,与题意不符,A错误;
B.分子式为C5H12的烃可为正戊烷、异戊烷和新戊烷,有3种同分异构体,与题意不符,B错误;
C.向2mL碘水中加入1mL苯,萃取分层,可观察到液体分层,上层呈紫红色,与题意不符,C错误;
D.煤中不含有苯和甲苯,苯和甲苯是煤的干馏产物,用蒸馏方法可以分离,符合题意,D正确;
故选D。

【题目】部分中学化学常见元素原子结构及性质如下表所示
元素 | 结构及性质 |
A | 元素A在第三周期中简单离子半径最小 |
B | B原子最外层电子数是内层电子数的0.6 |
C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
D | 元素D与B同主族,且大多数情况下D不显正化合价 |
E | 元素E在周期表中位于ⅠA族,有人认为将其排在ⅦA族也有一定道理 |
F | 元素F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)元素C在周期表中的位置是____元素;元素E形成的一种简单离子能支持“将元素E排在ⅦA族”这一观点,该离子的结构示意图为___。
(2)元素E与D可以按原子个数比2∶1、1∶1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为 __。E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式:___(用相应化学式表示)。
(3)请画出化合物F2B2的电子式:_____,该化合物中含有的化学键类型是___。
(4)元素A与元素F相比,金属性较强的是_________ (用元素符号表示),下列表述正确且能证明这一事实的是___(填字母代号)。
a.对应单质与酸反应时,每个A原子比每个F原子失电子多
b.对应单质与同浓度盐酸反应时,F比A剧烈得多
c.A的氧化物熔点比F的氧化物熔点高
d.F可将A从其盐溶液中置换出来
e.最高价氧化物对应的水化物的碱性F比A的强
【题目】a~n10中元素在周期表中的位置如图所示,请回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | m | n | ||||
…… |
(1)m的阴离子的结构示意图为___。
(2)b的最高价氧化物的化学式为___;用化学方程式表示f、d的单质形成f2d2的过程___。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___(用离子符号表示)。
(4)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
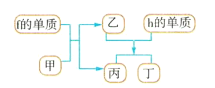
请写出h的单质与乙反应的化学方程式:___。
【题目】在 100℃时,将 0.40 mol NO2 气体充入 2 L 的密闭容器中,发生如下反应:2NO2(g)![]() N2O4(g) H < 0。监测反应获得如下数据:
N2O4(g) H < 0。监测反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法正确的是
A.0~20 s 内,v(NO2) = 0.005 mol·L-1.s-1
B.若上述反应在 120℃时进行,则反应至 80 s 时,n(N2O4) < 0.08 mol
C.若仅将起始时充入 NO2 的量增至 0.80 mol,达平衡时 NO2 转化率将减少
D.59 s 时,c(NO2)一定大于 0.12 mol·L-1