题目内容
10. 阿司匹林可由水杨酸与乙酸酐作用制得.其制备原理如下:
阿司匹林可由水杨酸与乙酸酐作用制得.其制备原理如下:主反应:
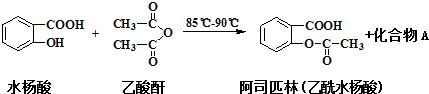
副反应:

已知:
①水杨酸可溶于水,乙酰水杨酸的钠盐易溶于水,聚水杨酸(固体)难溶于水;
②阿司匹林,白色针状或板状结晶或粉末,微溶于水;
阿司匹林可按如下步骤制取和纯化:
步骤1:在干燥的50mL圆底烧瓶中加入2g水杨酸、5mL乙酸酐和5滴浓硫酸,振荡使水杨酸全部溶解;
步骤2:按图所示装置装配好仪器,通水,在水浴上加热5~10min,用电炉控制温度在85~90℃;
步骤3:反应结束后,取下反应瓶,冷却,再放入冰水中冷却、结晶、过滤、冷水洗涤2~3次,继续过滤得粗产物;
步骤4:将粗产物转移至150mL烧杯中,在搅拌下加入25mL饱和碳酸氢钠溶液,充分搅拌,然后过滤;
步骤5:将滤液倒入10mL 4mol/L盐酸溶液,搅拌,将烧杯置于冰浴中冷却,使结晶完全.过滤,再用冷水洗涤2~3次.
(1)主反应中,生成物中化合物A是乙酸(CH3COOH);
(2)步骤2中组装仪器还需要一种玻璃仪器,名称是温度计,该仪器的位置如何摆放?温度计的水银球浸在水浴中,但不触及容器底部;冷凝管的作用是冷凝回流,冷凝管通水,水应从b(填“a”或“b”)口进.
(3)步骤4过滤得到的固体为聚水杨酸;
(4)经过步骤5得到产物,发生反应的化学方程式为
 ;
;(5)最后得到的阿司匹林可能会有少量未反应的水杨酸.如何用实验的方法检验步骤5中得到的晶体是否含有水杨酸?取少量步骤5获得的晶体于试管中,加入适量的水溶解,再加入1~2滴三氯化铁溶液,若溶液变紫色,则有水杨酸,若溶液没有变紫色,则没有水杨酸.若阿司匹林晶体含有水杨酸,还需要采用重结晶方法,进一步纯化晶体.
分析 (1)主反应中水杨酸和乙酸酐发生取代反应生成阿司匹林,同时生成乙酸(CH3COOH);
(2)发生反应时温度控制在85~90℃,需要测量温度的仪器;测量的温度是水浴温度;
冷凝管起冷凝回流作用;用冷凝管冷却蒸气时,冷凝管中水流方向为逆流;
(3)乙酰水杨酸和碳酸氢钠反应生成二氧化碳和水,水杨酸发生缩聚反应生成聚水杨酸,聚水杨酸难溶于水;
(4)滤液中主要成分是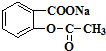 ,
,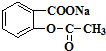 和稀盐酸反应生成阿司匹林;
和稀盐酸反应生成阿司匹林;
(5)阿司匹林和双氧水的区别是水杨酸含有酚羟基、阿司匹林含有酯基,可以用氯化铁溶液检验酚羟基;
如果阿司匹林中含有水杨酸,需要除去水杨酸得到较纯净的阿司匹林.
解答 解:(1)主反应中水杨酸和乙酸酐发生取代反应生成阿司匹林,根据取代反应特点知同时生成乙酸(CH3COOH),故答案为:乙酸(CH3COOH);
(2)发生反应时温度控制在85~90℃,需要测量温度的仪器,为温度计;测量的温度是水浴温度,所以温度计的水银球应该浸在水浴中,且不能触及容器底部;
冷凝管起冷凝回流作用;用冷凝管冷却蒸气时,冷凝管中水流为逆流,所以b进水口;
故答案为:温度计;温度计的水银球浸在水浴中,但不触及容器底部;冷凝回流;b;
(3)乙酰水杨酸和碳酸氢钠反应生成二氧化碳和水,水杨酸发生缩聚反应生成聚水杨酸,聚水杨酸难溶于水,所以得到的固体是聚水杨酸,
故答案为:聚水杨酸;
(4)滤液中主要成分是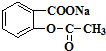 ,
,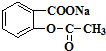 和稀盐酸反应生成阿司匹林,反应方程式为
和稀盐酸反应生成阿司匹林,反应方程式为 ,故答案为:
,故答案为: ;
;
(5)阿司匹林和双氧水的区别是水杨酸含有酚羟基、阿司匹林含有酯基,可以用氯化铁溶液检验酚羟基,检验方法为:取少量步骤5获得的晶体于试管中,加入适量的水溶解,再加入1~2滴三氯化铁溶液,若溶液变紫色,则有水杨酸,若溶液没有变紫色,则没有水杨酸;
如果阿司匹林中含有水杨酸,需要除去水杨酸得到较纯净的阿司匹林,应该采用重结晶方法,
故答案为:取少量步骤5获得的晶体于试管中,加入适量的水溶解,再加入1~2滴三氯化铁溶液,若溶液变紫色,则有水杨酸,若溶液没有变紫色,则没有水杨酸;重结晶.
点评 本题考查物质制备实验方案设计,为高频考点,明确实验原理是解本题关键,知道每个实验步骤目的及基本操作方法,易错点是冷凝管中水流方向判断,题目难度不大.

 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH$\stackrel{H_{2}SO_{4}}{→}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
反应物和产物的相关数据列表如下:
| 化合物 名称 | 密度(g/mL ) | 熔 点(℃) | 沸 点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.回答下列问题:
(1)该实验时球形冷凝管的进水口为2(填1或2);
(2)在该实验中,三口烧瓶的容积最适合的是A(填入正确选项前的字母).
A.50mL B.150mL C.250mL D.500mL
(3)本实验中容易产生烃类化合物的化学反应方程式为:HOCH2CHBrCH2CH3 $→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3+H2O.
(4)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,得到有机层的操作方法是将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁留下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出.
(5)有机层粗产物依次用12mL水、8mL5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液溶液洗涤的目的是除去产品中的硫酸;用氯化钙溶液洗涤的目的是除去少量的氢氧化钠,且能减少产物的损失.
(6)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏 b.过滤 c.加入无水CaCl2
(7)本实验所得到的正丁醚产率为35.34%.
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
请完成并配平上述化学方程式.其中氧化剂是K2Cr2O7,氧化产物是CO2
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H
下表所列数据是该反应在不同温度下的化学平衡常数(Κ).
| 温 度 | 250℃ | 300℃ | 350℃ |
| Κ | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃.
③请在下列坐标中的画出②中求得温度下CO、H2和 CH30H的浓度随时间变化的曲线,并进行适当的标注.
(3)工业上也可以用CO2和H2反应制得甲醇.在2×105Pa、300℃的条件下,若有440g CO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出该反应的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ•mol-1.
(4)以CH3OH为燃料(以 KOH 溶液作电解质溶液)可制成CH3OH燃料电池,则充入CH3OH的电极为负极,充入O2电极的反应式为O2+4e-+2H2O=4OH-.
| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

| A. | 温度升髙,该反应的平衡常数减小 | |
| B. | 0〜10min,HCOOCH3的平均反应速率v=0.003mol•L-1min-1 | |
| C. | HCOOCH3水解平均反应速率先是增大,后减小,最后保持不变 | |
| D. | 该条件下达到平衡状态,反应物转化率相等 |
| A. | 两种溶液中的c(Na+)相等 | |
| B. | 分别加水稀释到100 mL时,两种溶液的pH依然相等 | |
| C. | 两溶液中由水电离出的c(OH-)之比为10-9/10-5 | |
| D. | 分别与同浓度的盐酸反应,pH=7时消耗的盐酸体积相等 |
| A. | 200ml 2mol/L Mg Cl2溶液 | B. | 1000 ml 2.5 mol/LNaCl | ||
| C. | 300 ml 5 mol/L K Cl 溶液 | D. | 250 ml 1 mol/L AlCl3 |
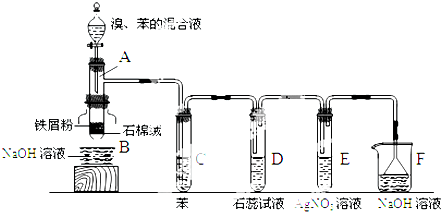
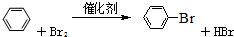 .
.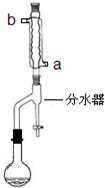 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.