题目内容
4.(1)49gH2SO4的物质的量为0.5mol,所含氧原子的质量为32g;(2)同温同压下,同体积的A气体和H2的质量分别是4.8g和0.2g,则气体A的摩尔质量为48g/mol,A与氢气的物质的量之比为1:1.
(3)有二氧化碳与一氧化碳的混合气体共10.8g,其物质的量为0.3mol.则混合气体中二氧化碳的物质的量为0.15mol,一氧化碳的质量分数为38.9%.
分析 (1)硫酸的物质的量n=$\frac{m}{M}$;1mol硫酸中含4mol氧原子,根据m=nM来计算;
(2)根据同温同压下,同体积的气体的物质的量相同,根据氢气的质量求出其物质的量n=$\frac{m}{M}$,即可得出A的物质的量,然后根据摩尔质量M=$\frac{m}{n}$来计算;
(3)设混合气体中CO的物质的量为xmol,二氧化碳的物质的量为ymol,根据质量列式可得:28x+44y=10.8 ①
根据物质的量列式可得:x+y=0.3 ②
解①②可得x、y.
解答 解:(1)49g硫酸的物质的量n=$\frac{m}{M}$=$\frac{49g}{98g/mol}$=0.5mol;由于1mol硫酸中含4mol氧原子,故0.5mol硫酸中含2mol氧原子,质量m=nM=2mol×16g/mol=32g,故答案为:0.5mol,32g;
(2)同温同压下,同体积的A气体和氢气的物质的量相同,0.2g氢气的物质的量n=$\frac{m}{M}$=$\frac{0.2g}{2g/mol}$=0.1mol,故气体A的物质的量也为0.1mol,故A的摩尔质量M=$\frac{m}{n}$=$\frac{4.8g}{0.1mol}$=48g/mol,故答案为:48g/mol,1:1;
(3)设混合气体中CO的物质的量为xmol,二氧化碳的物质的量为ymol,根据质量列式可得:28x+44y=10.8 ①
根据物质的量列式可得:x+y=0.3 ②
解①②可得:x=0.15mol,y=0.15mol.
故CO的质量分数=$\frac{0.15mol×28g/mol}{10.8g}×100%$=38.9%
故答案为:0.15mol,38.9%.
点评 考查阿伏伽德罗定律及推论、常用化学计量的有关计算,难度不大,可以借助pV=nRT理解阿伏伽德罗定律及推论.

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案| A. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
| 甲 | 乙 | |
| A | 物质A的分子数 | 一个A分子的质量 |
| B | 标准状况下气体摩尔体积 | 标准状况下气体体积 |
| C | 固体体积 | 固体密度 |
| D | 非标准状况下物质的质量 | 物质的摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
| A. | ①③④ | B. | ②④ | C. | ③④ | D. | ①②③ |
 ⑥
⑥ ⑦
⑦

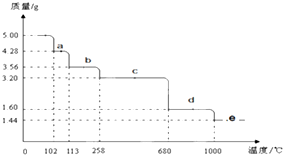 Cu2S是火法炼铜的重要原料之一,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:
Cu2S是火法炼铜的重要原料之一,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图: 阿司匹林可由水杨酸与乙酸酐作用制得.其制备原理如下:
阿司匹林可由水杨酸与乙酸酐作用制得.其制备原理如下: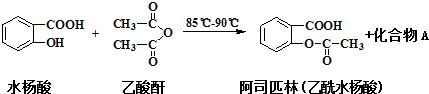

 ;
;