题目内容
16.某课外小组设计的实验室制取乙酸乙酯的装置如图所示.已知: ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH②有关物质的沸点如下表所示:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)若用同位素18O表示反应产物是分子中的氧原子,请写出反应的化学方程式(标明18O在反应物中的位置):CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)分液漏斗A中应加入的试剂为浓硫酸,圆底烧瓶B中应加入少量碎瓷片,目的为防止暴沸.
(3)球形干燥管C的作用为防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(4)从D中分离出乙酸乙酯的操作名称为分液;这样得到乙酸乙酯中常含有一定量的乙醇、乙醚和水,欲得到较纯净的乙酸乙酯,应先加入无水氯化钙,目的是分离出乙醇和水;最后进行蒸馏,收集77℃左右的馏分,得到比较纯净的乙酸乙醇.
分析 (1)羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水;
(2)分液漏斗A中应加入的试剂为浓硫酸,起催化和脱水的作用,得利反应的正向进行;液体加热要加沸石或碎瓷片,防止暴沸;
(3)圆底烧瓶受热不均,球形干燥管的管口伸入液面下可能发生倒吸,同时起冷凝作用;
碳酸根水解,溶液呈碱性,反应后溶液分层,上无色油体液体,由于碳酸钠与乙酸反应,故下层溶液颜色变浅;
(4)用分液的方法分离出酯层,用氯化钙除去少量乙醇和水.
解答 解:(1)羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水,其它基团相互结合生成酯,同时该反应可逆,反应的化学方程式为CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O,故答案为:CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O;
(2)分液漏斗A中应加入的试剂为浓硫酸,起催化和脱水的作用,得利反应的正向进行;液体加热要加沸石或碎瓷片,防止暴沸;故答案为:浓硫酸;防止暴沸;
(3)圆底烧瓶受热不均,球形干燥管的管口伸入液面下可能发生倒吸,球形干燥管体积大,可以防止倒吸,同时起冷凝作用;
碳酸根水解CO32-+H2O?HCO3-+OH-,溶液呈碱性,加入几滴酚酞,溶液呈红色;
碳酸钠水解呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,溶液分层,上层无色油体液体,乙酸和碳酸钠反应而使溶液红色变浅;
故答案为:防止倒吸、冷凝;溶液分层,上层无色油体液体,下层溶液颜色变浅;
(4)用分液的方法分离出酯层,用氯化钙除去少量乙醇和水,最后进行蒸馏,收集77℃左右的馏分,得到比较纯净的乙酸乙醇,故答案为:分液;乙醇和水.
点评 本题考查了乙酸乙酯的制备与实验改进,题目难度中等,注意实验原理和浓硫酸、球形管的作用,体会实验改进的优点.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | 浓H2SO4滴在白纸上发黑,说明弄浓H2SO4具有脱水性 | |
| B. | 浓H2SO4和浓HCl混合可制氯化氢,说明浓H2SO4具有吸水性 | |
| C. | 常温下,浓H2SO4可以用铝罐贮存,说明铝与浓H2SO4不反应 | |
| D. | 反应CuSO4+H2S→CuS+H2SO4能在溶液中完全进行,证明CuS既不溶于水也不溶于稀H2SO4 |
| A. | 原子半径的大小顺序:r(B)>r(C)>r(D) | |
| B. | B的简单气态氢化物的热稳定性比D的强 | |
| C. | E的最高价氧化物对应水化物的酸性在同周期中最强 | |
| D. | E分别与A、C形成的化合物中化学键类型相同 |
| A. | 1L pH=1的乙酸溶液中H+数小于0.1NA | |
| B. | 标准状况下,22.4L乙醇的分子数为NA | |
| C. | 28g乙烯和丙烯所含碳氢键的数目为4NA | |
| D. | 1 mol 甲基所含的电子数为10NA |
| A. | NaOH | B. | Na2SO4 | C. | HCl | D. | NH4Cl |
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 | |
| C. | 聚合物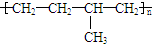 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 | |
| D. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量相等 |


 .
. .
.