题目内容
4.氨基酸分子中既有羧基,又有氨基,因此它具有两性.√(判断对错)分析 氨基酸分子中含有氨基(-NH2,具有碱的性质)和羧基(-COOH,具有酸的性质),据此解题.
解答 解:氨基酸分子中含有氨基(-NH2,具有碱的性质)和羧基(-COOH,具有酸的性质),因此它具有两性,故答案为:√.
点评 本题考查氨基酸、蛋白质的结构和性质特点,题目难度不大,解答本题的关键是把握相关物质的性质,学习中注意积累.

练习册系列答案
相关题目
14.以下对核外电子运动状况的描述正确的是( )
| A. | 同一原子中,2p,3p,4p能级的轨道依次增多 | |
| B. | 当碳原子的核外电子排布由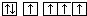 转变为 转变为 这一过程释放能量 这一过程释放能量 | |
| C. | 3p2表示3p能级有两个轨道 | |
| D. | 在同一能级上运动的电子,其运动状态可能相同 |
15.下列说法正确的是( )
| A. | 苯分子中含有碳碳双键 | |
| B. | 烃是指只含有碳、氢元素的有机物 | |
| C. | 燃烧后能产生C02和H20的有机物一定是烃 | |
| D. | 葡萄糖溶液中加人新制Cu(OH)2悬浊液,振荡,产生砖红色沉淀 |
12.下列化学电池不易造成环境污染的是( )
| A. | 锌锰电池 | B. | 氢氧燃料电池 | C. | 镍镉电池 | D. | 铅蓄电池 |
19.下列化学用语表达正确的是( )
| A. | 羟基的电子式: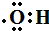 | B. | 聚丙烯结构简式: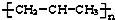 | ||
| C. | CO2的比例模型: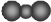 | D. | 乙烯的结构简式:CH2CH2 |
9.下列化学式不只表示一种物质的是( )
| A. | C3H8 | B. | C4H10 | C. | CHCl3 | D. | CH2Cl2 |
16. 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A. | 第二份溶液中最终溶质为FeSO4 | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| C. | 原混合酸中NO3- 物质的量为0.1 mol | |
| D. | H2SO4 浓度为2.5 mol•L-1 |
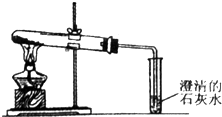
16.某课外小组设计的实验室制取乙酸乙酯的装置如图所示.已知:
 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关物质的沸点如下表所示:
请回答:
(1)若用同位素18O表示反应产物是分子中的氧原子,请写出反应的化学方程式(标明18O在反应物中的位置):CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)分液漏斗A中应加入的试剂为浓硫酸,圆底烧瓶B中应加入少量碎瓷片,目的为防止暴沸.
(3)球形干燥管C的作用为防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(4)从D中分离出乙酸乙酯的操作名称为分液;这样得到乙酸乙酯中常含有一定量的乙醇、乙醚和水,欲得到较纯净的乙酸乙酯,应先加入无水氯化钙,目的是分离出乙醇和水;最后进行蒸馏,收集77℃左右的馏分,得到比较纯净的乙酸乙醇.
 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH②有关物质的沸点如下表所示:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)若用同位素18O表示反应产物是分子中的氧原子,请写出反应的化学方程式(标明18O在反应物中的位置):CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)分液漏斗A中应加入的试剂为浓硫酸,圆底烧瓶B中应加入少量碎瓷片,目的为防止暴沸.
(3)球形干燥管C的作用为防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(4)从D中分离出乙酸乙酯的操作名称为分液;这样得到乙酸乙酯中常含有一定量的乙醇、乙醚和水,欲得到较纯净的乙酸乙酯,应先加入无水氯化钙,目的是分离出乙醇和水;最后进行蒸馏,收集77℃左右的馏分,得到比较纯净的乙酸乙醇.