题目内容
17.工业上,向500~600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁.现用如图所示的装置模拟上述过程进行实验.
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置B中加入的试剂是浓硫酸.
(2)制取无水氯化亚铁的实验中,装置A用来制取HCl.尾气的成分是HCl和H2.若仍用D装置进行尾气处理,存在的问题是发生倒吸、可燃性气体H2不能被吸收.
(3)若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是KSCN溶液.欲制得纯净的FeCl2,在实验操作中应先点燃A处的酒精灯,再点燃C处的酒精灯.
分析 (1)实验室利用二氧化锰与浓盐酸加热反应制取氯气,浓硫酸可以干燥氯气;
(2)制取无水氯化亚铁,需要HCl气体,尾气的成分是剩余HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水,据此解答即可;
(3)检验氯化铁常用硫氰化钾溶液,若要制取纯净的FeCl2,需先点燃A处的酒精灯排除装置中的空气,据此解答即可.
解答 解:(1)制取无水氯化铁的实验中,A装置制取的是氯气,实验室常用浓盐酸与二氧化锰加热制取,化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置B的作用是干燥氯气,常用浓硫酸,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;浓硫酸;
(2)制取无水氯化亚铁,需要HCl气体,故A装置制取的是HCl,反应方程式为:Fe+2HCl$\frac{\underline{\;\;△\;\;}}{\;}$FeCl2+H2,故尾气的成分为未反应的HCl和生成的氢气,由于HCl极易溶于水,故若仍然采用D装置进行尾气处理,很容易造成倒吸,且氢气不溶于水,不利于氢气的吸收,氢气易燃,造成安全隐患,故答案为:HCl;HCl和H2;发生倒吸;可燃性气体H2不能被吸收;
(3)检验氯化铁常用硫氰化钾溶液,若要制取纯净的FeCl2,需先排净装置中的空气,故先点燃A处的酒精灯,再点燃C处的酒精灯,故答案为:KSCN;点燃A处的酒精灯;点燃C处的酒精灯.
点评 本题以氯化铁以及氯化亚铁的制取为载体,考查的是实验室中氯气的制取方法、常见尾气的处理方法以及铁离子的检验等,难度一般.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
7.过氧乙酸(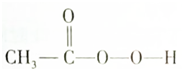 )是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )
)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )
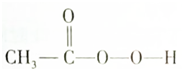 )是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )
)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )| A. | 过氧乙酸溶液与碳酸钙反应能产生二氧化碳气体 | |
| B. | 过氧乙酸与乙醇能发生酯化反应 | |
| C. | 过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体 | |
| D. | 由过氧化氢与醋酸制取过氧乙酸的反应属于氧化还原反应 |
5.0.1mol下列气体分别与1L0.1mol•L-1的NaOH溶液反应,形成的溶液pH最小的是( )
| A. | NO2 | B. | SO2 | C. | SO3 | D. | CO2 |
18.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
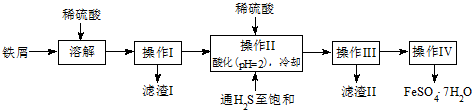
查询资料,得25℃时有关物质的数据如下表:
(1)操作Ⅱ中,先通入硫化氢至饱和,目的是除去溶液中的Sn2+离子;后加入硫酸酸化至pH=2的作用是防止Fe2+离子生成沉淀.
(2)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
③判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:部分Fe2+被空气中O2氧化.

查询资料,得25℃时有关物质的数据如下表:
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(2)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
③判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:部分Fe2+被空气中O2氧化.




 .
.

 (或
(或
 );
);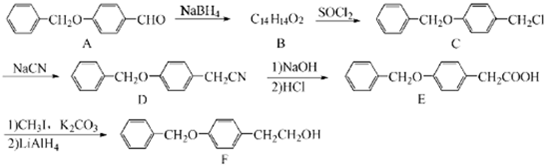
 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应. .
. 为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.