题目内容
18.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法: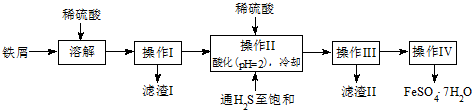
查询资料,得25℃时有关物质的数据如下表:
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(2)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
③判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:部分Fe2+被空气中O2氧化.
分析 铁屑加入稀硫酸生成硫酸亚铁、硫酸锡,过滤后得到滤液,将滤液加入稀硫酸酸化,并通入硫化氢,可生成SnS沉淀并防止亚铁离子被氧化,过滤后得到滤液为硫酸亚铁,经蒸发浓硫酸、冷却结晶、过滤可得到FeSO4•7H2O,
解答 解:铁屑加入稀硫酸生成硫酸亚铁、硫酸锡,过滤后得到滤液,将滤液加入稀硫酸酸化,并通入硫化氢,可生成SnS沉淀并防止亚铁离子被氧化,过滤后得到滤液为硫酸亚铁,经蒸发浓硫酸、冷却结晶、过滤可得到FeSO4•7H2O,
(1)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
故答案为:除去溶液中的Sn2+离子;防止Fe2+离子生成沉淀;
(2)②冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,
故答案为:降低洗涤过程中FeSO4•7H2O的损耗;
(3)①酸性KMnO4被FeSO4还原时生成Mn2+,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②高锰酸钾具有强氧化性,可腐蚀橡皮管,应放在酸式滴定管中,故答案为:酸式滴定管;
③滴定实验达到终点时,滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色,
故答案为:滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
④Fe2+具有还原性,易被空气中氧化而变质,常常导致测定结果偏低,故答案为:部分Fe2+被空气中O2氧化.
点评 本题考查了铁盐亚铁盐的性质应用,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,题目着重于分离混合物的实验方法设计和分析判断的考查,注意把握滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.

| t/s | 0 | t1 | t2 | t3 | t4 |
| n(so3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3反应达到新平衡时SO3转化率升高 |
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 | 说明原溶液中一定含所有FeCl3 |
| B | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2$\stackrel{Na_{2}CO_{3}}{→}$NaOH | 用生石灰制备NaOH溶液 |
| C | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀 | 酸雨中一定含有SO42- |
| D | H3PO3+2NaOH(足量)-Na2HPO3+2H2O | H3PO3属于三元酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在上述溶液中加入少量的NaOH或HCl溶液时,溶液的pH有可能不会发生显著变化 | |
| B. | 溶液中四种离子之间有可能满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 当溶液中溶质为CH3COONa和NaOH时,则一定有c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 当四种离子之间能满足c(CH3COO-)>c(Na+)>c(H+)>c(OH)时,则溶液中溶质一定是CH3COONa和CH3COOH |
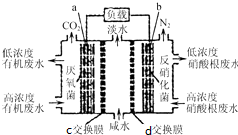 一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )
一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )| A. | 电子从a极经负载到b极 | |
| B. | c为氯离子交换膜,d为钠离子交换膜,中间室可用作海水淡化 | |
| C. | 负极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | 反应后将左右两室溶液混合较反应前两室溶液混合的酸性强 |

 (1)金刚石和石墨的晶胞如图,若碳原子半径为a cm 且相邻最近的碳原子相切,阿伏加德罗常数为NA,则金刚石的密度表达式为(要求整理为分母不含根号的表达式)$\frac{9\sqrt{3}}{1{6a}^{3}{N}_{A}}$g/cm3,一个石墨晶胞内含有4个碳原子,石墨的熔点比金刚石的熔点要高,其原因是石墨中碳碳键长小于金刚石中碳碳键长,这两种晶胞中碳的配位数(每个碳周围与之最近的碳原子数)之比为4:3.
(1)金刚石和石墨的晶胞如图,若碳原子半径为a cm 且相邻最近的碳原子相切,阿伏加德罗常数为NA,则金刚石的密度表达式为(要求整理为分母不含根号的表达式)$\frac{9\sqrt{3}}{1{6a}^{3}{N}_{A}}$g/cm3,一个石墨晶胞内含有4个碳原子,石墨的熔点比金刚石的熔点要高,其原因是石墨中碳碳键长小于金刚石中碳碳键长,这两种晶胞中碳的配位数(每个碳周围与之最近的碳原子数)之比为4:3.
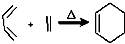 RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.请按要求回答下列问题:
RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.请按要求回答下列问题: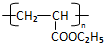 .
.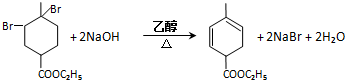 .
. 均2个,反应④的化学方程式为
均2个,反应④的化学方程式为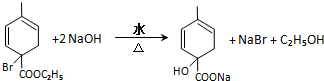 .
. .
.