题目内容
8.写出下列单体聚合物得到的聚合物结构简式.(1)丙烯;
(2)丙烯酸甲酯;
(3)对苯二甲酸和1,4-丁二醇.
分析 (1)丙烯加聚反应生成聚丙烯;
(2)丙烯酸甲酯聚合时断开碳碳双键,据此书写;
(3)对苯二甲酸与1,4-丁二醇发生缩聚反应生成酯类,据此解答即可.
解答 解:(1)丙烯发生加聚反应生成聚丙烯,化学方程式为: ;故答案为:
;故答案为: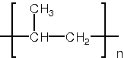
(2)丙烯酸甲酯发生加聚反应生成聚丙烯酸甲酯,结构简式为: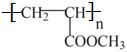 ,故答案为:
,故答案为: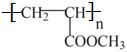 ;
;
(3)对苯二甲酸与1,4-丁二醇发生缩聚反应生成酯类,即二元醇与二元酸反应生成酯类,结构简式为: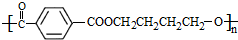 ,故答案为:
,故答案为: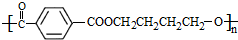 .
.
点评 本题主要考查的是高聚物结构简式的书写,熟练掌握发生加聚或缩聚的反应原理是解决本题的关键,难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
18.常温,下列各组离子一定能大量共存的是( )
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在透明溶液中:Na+、Cu2+、SO42-、NO3- | |
| C. | 在c(H+)=10-13 mol/L的溶液中:NH4+、Al3+、SO42-、CO32- | |
| D. | 在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
19.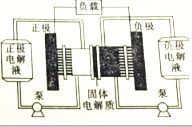 燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
 燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )| A. | 该电池应该在负极通入空气 | |
| B. | 放电时,Li+透过固体电解质向负极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+2e-═2Cu+O2- | |
| D. | 整个反应过程中,铜相当于催化剂,氧化剂实质是O2 |
3.设NA 代表阿伏加德罗常数,下列说法不正确的是( )
| A. | 30g HCHO与过量的新制的氢氧化铜悬浊液反应转移了4NA个电子 | |
| B. | 1L 1mol/L 醋酸溶液中分子总数小于NA | |
| C. | 在1mol-CHO中所含电子数为15NA | |
| D. | 1mol CaHxNbOc的有机物中,H最多(2a+b+2)NA |
13.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molCnH2n+2中含有的C-C键数为(n-1)NA | |
| B. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 标准状况下,2.24 L CHCl3的原子总数为0.5 NA |
20.乙苯催化脱氢制苯乙烯反应:
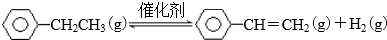
(1)已知:
计算上述反应的△H=+124 kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
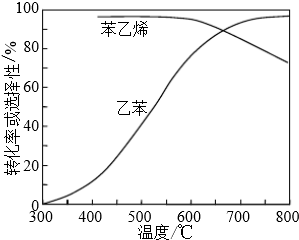
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
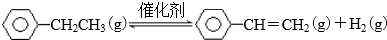
(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
9.一定温度下,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(so3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3反应达到新平衡时SO3转化率升高 |
