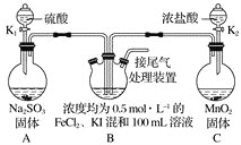
题目内容
【题目】25 ℃时,向25mL0.1 mol·L-1 NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是( )
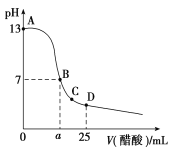
A.在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.C点对应的溶液中,水电离出的H+浓度大于10-7 mol·L-1
C.用含a的代数式表示CH3COOH的电离平衡常数K=![]()
D.D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)= 2c(H+)-c(OH-)
【答案】C
【解析】
在25mL 0.1mol。L-1NaOH溶液中逐滴加入0.2molL-1 CH3COOH 溶液,二者之间相互反应,当恰好完全反应时,所需醋酸的体积为12.5mL,当反应至溶液显中性时,醋酸应稍过量,且c(OH-)=c(H+),注意根据电荷守恒思想来比较离子浓度大小。
A.在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)<c(OH-),溶液中离子浓度大小关系可能为:c (Na+)>c (CH3COO-)>c (OH-)>c (H+),但也可能是氢氧化钠过量,c (Na+)>c (OH-)>c (CH3COO-)>c (H+),故A错误;
B.c点对应的溶液中,醋酸过量,溶液呈酸性,对水的电离有抑制作用,水电离出的H+浓度小于10-7molL-1,故B错误;
C.a点时醋酸过量,溶液呈中性c (H+)=10-7molL-1,c(CH3COOH)=![]() mol/L=
mol/L=![]() mol/L,c(CH3COO-)=c(Na+)=
mol/L,c(CH3COO-)=c(Na+)=![]() mol/L=
mol/L=![]() mol/L,Ka(CH3COOH)=
mol/L,Ka(CH3COOH)=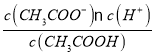 =
=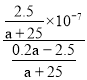 =
=![]() ,故C正确;
,故C正确;
D.D点对应的溶液中,c(CH3COO-)=c(CH3COOH),c(CH3COO-)+c(CH3COOH)=2c(Na+),电荷关系为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-),故D错误;
故答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】无机化合物可根据其组成和性质进行分类。
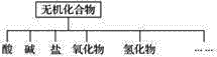
(1)上图所示的物质分类方法名称是____________。
(2)以钠、钾、氢、氧、碳、硫、氮中任两种或三种元素组成合适的物质,分别填在下表中的横线上:
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②____ | ③____ ④Ba(OH)2 | ⑤Na2CO3 ⑥____ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出⑦转化为⑤的化学方程式__________。
(4)写出实验室由⑩制备氧气的化学方程式______。
(5)实验室制备⑦常用________和________反应,检验该气体的方法是________。