��Ŀ����
����Ŀ��Ϊ��̽��Cl2��SO2ͬʱͨ��H2O�з����ķ�Ӧ��ijУ��ѧ��ȤС��ͬѧ�������ͼ��ʾ��ʵ��װ�á�

��1���û�ѧ��ȤС���ͬѧΪ��ȡCl2��SO2���壬�ֲ���Na2SO3��70%������Ϊԭ����ȡSO2������MnO2��Ũ����(12 mol��L��1)Ϊԭ����ȡCl2���ڴ�ʵ���У�F������������________������װ��BӦѡ����������װ���е�________(�����)��
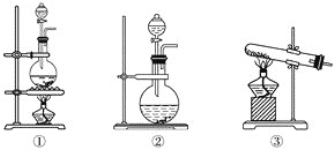
��2��Dװ������Ҫ��Ӧ�����ӷ���ʽΪ____________________________________________________��
��3��Ϊ��֤ͨ��Dװ���е�������Cl2��������SO2��������ȤС���ͬѧ���������Լ���
���Ȼ�����Һ�����Ȼ�������Һ�������軯����Һ�������Ը��������Һ
��Cl2������ȡ����D����Һ�μ���ʢ��________(��һ����ţ���ͬ)�Լ����Թ��ڣ��ټ���________�Լ���������������_____________________________________________��
��SO2������ȡ����D����Һ�μ���ʢ��________�Լ����Թ��ڣ�������������________________________________________________________________________��
���𰸡� ������ �� Cl2��SO2��2H2O��4H����SO42����2Cl�� �� �� ��Һ�ʺ�ɫ �� �Ϻ�ɫ��Ϊ��ɫ
����������1��SO2����ˮ��Ӧ�����ܽ�Ƚϴ�ᷢ����������Fװ�õ������ǿ��Է�������װ��BΪ��ȡ������װ�ã��ɹ�Һ��Ӧ�Ҽ��ȵ�ԭ����֪Ӧѡ��٣���2��D���Ƕ������������������������ԭ��Ӧ������������ᣬ��Ӧ�����ӷ���ʽΪCl2��SO2��2H2O��4H����SO42����2Cl������3����Cl2��������ˮ����ǿ�����ԣ������ȡ����D����Һ�μ���ʢ���Ȼ�������Һ�Լ����Թ��ڣ��ټ������軯����Һ���Ѫ��ɫ��֤�����������������ӣ���SO2����������������л�ԭ�ԣ������ȡ����D����Һ�μ���ʢ�����Ը��������Һ���Թ��У�������������������Ϻ�ɫ��Ϊ��ɫ֤�����ж�������





