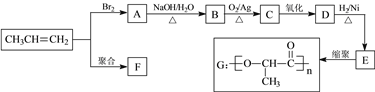
题目内容
【题目】实验题:
(1)下列说法正确的是_________
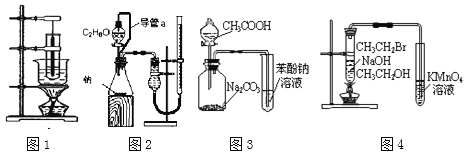
A.图1为实验室制备硝基苯的装置
B.图2可以用于测定乙醇分子结构
C.图3装置可以达到验证酸性:CH3COOH > H2CO3 > C6H5OH的目的
D.图4装置可以达到验证溴乙烷发生消去反应生成烯烃的目的
(2)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为____________________。
②滴定终点的现象是___________________。
③滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol·L—1NH4Fe(SO4)2标准溶液20mL,则TiO2的质量分数为________________。
④若在滴定终点读取滴定管刻度时,俯视标准溶液的液面,使其测定结果__________(填“偏大”“偏小”或“无影响”)。
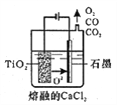
⑤工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法生产钛是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_________。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与Cr![]() 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为______mol·L-1,此时溶液中c(Cr
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为______mol·L-1,此时溶液中c(Cr![]() )等于_______mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
)等于_______mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
【答案】 B TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl 滴入最后一滴标准溶液时, 锥形瓶内溶液变成红色, 且半分钟不褪色 80% 偏小 TiO2+4e-==Ti+2O2- 2.0×10-5 5.0×10-3
TiO2·xH2O↓+4HCl 滴入最后一滴标准溶液时, 锥形瓶内溶液变成红色, 且半分钟不褪色 80% 偏小 TiO2+4e-==Ti+2O2- 2.0×10-5 5.0×10-3
【解析】(1)考查实验方案设计与评价,A、制备硝基苯,温度计的水银球应插入水浴中,故A错误;B、C2H6O的结构简式可能是CH3CH2OH,也可能是CH3-O-CH3,因此通过与金属钠反应,测产生氢气与C2H6O的物质的量关系,确认乙醇的结构简式,如果是乙醇和氢气的物质的量之比为2:1,则乙醇的结构简式为CH3CH2OH,反之则为CH3-O-CH3,故B正确;C、因为乙酸也挥发,因此从广口瓶中逸出的气体中混有乙酸,对后续实验产生干扰,故C错误;D、乙醇也能使酸性高锰酸钾溶液褪色,从试管中出来的气体中混有乙醇,对实验产生干扰,故D错误;(2)考查滴定实验、量的测定和电极反应式的书写,①TiCl4发生水解,其化学反应方程式为TiCl4+(2+x)H2O=TiO2·xH2O↓+4HCl;②TiO2中Ti的化合价由+4价→+3价,化合价降低,把Fe2+氧化成Fe3+,Fe3+与KSCN溶液,溶液变红,即滴定到终点的现象是:滴入最后一滴标准溶液时, 锥形瓶内溶液变成红色, 且半分钟不褪色 ;③依据得失电子数目守恒,有:n(Fe2+)×1=n(TiO2)×1,即n(TiO2)=n(Fe2+)=20×10-3×0.1mol=2×10-3mol,其质量分数为2×10-3×80/0.2×100%=80%;④滴定终点读取滴定管刻度时,俯视标准溶液的液面,标准溶液的体积偏小,因此所测结果偏小;⑤根据电极原理,TiO2为阴极,根据装置图O2-从阴极移向阳极,即阴极反应式为TiO2+4e-=Ti+2O2-;(3)考查溶度积的计算,Cl-恰好转化成沉淀,此时c(Ag+)=Ksp(AgCl)/c(Cl-)=2.0×10-10/10-5mol·L-1=2×10-5mol·L-1,此时溶液中c(CrO42-)=Ksp(Ag2CrO4)/c2(Ag+)=2×10-12/(2×10-5)2mol·L-1=5×10-3mol·L-1。

【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
ⅰ.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1
H2S(g)+CO2(g) △H1
ⅱ.氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H2
H2S(g)+CO(g) △H2
已知反应中相关的化学键键能数据如下表:
化学键 | H-H | C=O(COS) | C=S | H-S |
|
E/kJ·mol-1 | 436 | 745 | 580 | 339 | 1076 |
①恒温恒压下,密闭容器中发生反应i。下列事实能说明反应i达到平衡状态的是_______。 (填标号)
a.容器的体积不再改变
b.化学平衡常数不再改变
c.混合气体的密度不再改变
d.形成1molH—O键,同时形成1molH—S键
②一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)

③反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为_____________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。
②Ksp(HgS)=_____________________。