题目内容
【题目】由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。

(1)聚合物F的结构简式是____________。
(2)D的结构简式是________________。
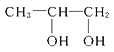
(3)B转化为C的化学方程式是_____________________。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是_____________________________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol H2,则该种同分异构体为_____________________________________。
【答案】 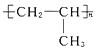
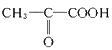
 +O2
+O2![]()
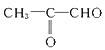 +H2O
+H2O 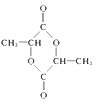 HOCH2CH(OH)CHO
HOCH2CH(OH)CHO
【解析】本题考查有机物的推断和合成,(1)丙烯中含有碳碳双键,能发生加聚反应,因此F的结构简式为: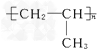 ;(2)丙烯与Br2发生加成反应,则A的结构简式为CH3CHBrCH2Br,A在氢氧化钠水溶液中发生水解反应,即B的结构简式为CH3CH(OH)CH2OH,B发生氧化反应,C的结构简式为:
;(2)丙烯与Br2发生加成反应,则A的结构简式为CH3CHBrCH2Br,A在氢氧化钠水溶液中发生水解反应,即B的结构简式为CH3CH(OH)CH2OH,B发生氧化反应,C的结构简式为:![]() ,C中醛基进一步被氧化成羧基,即D的结构简式为
,C中醛基进一步被氧化成羧基,即D的结构简式为![]() ;(3)根据(2)的分析,即B生成C的化学反应方程式为:
;(3)根据(2)的分析,即B生成C的化学反应方程式为: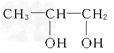 +O2
+O2![]()
![]() +H2O;(4)D是羰基与氢气发生加成反应,即E的结构简式为CH3CH(OH)COOH,两分子E通过酯化反应,生成环状化合物,即为
+H2O;(4)D是羰基与氢气发生加成反应,即E的结构简式为CH3CH(OH)COOH,两分子E通过酯化反应,生成环状化合物,即为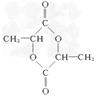 ;(5)能发生银镜反应,说明含有醛基,与足量钠反应,根据E的分子式,1mol同分异构体中含有2mol羟基,因此同分异构体为HOCH2CH(OH)CHO。
;(5)能发生银镜反应,说明含有醛基,与足量钠反应,根据E的分子式,1mol同分异构体中含有2mol羟基,因此同分异构体为HOCH2CH(OH)CHO。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】硫酸铵是化工、染织、医药、皮革等工业原料。某硫酸工厂利用副产品Y处理尾气SO2得到CaSO4,再与相邻的合成氨工厂联合制备(NH4)2SO4,工艺流程如下:
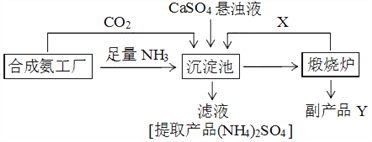
请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是_____
A.电离方程式:(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
B.水解离子方程式:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)=c(SO42-)+c(OH–)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3H2O)>c(OH–)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+ O2 ![]() 2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择下表中最合适的温度和压强分别是__________。该反应420℃时的平衡常数_____520℃时的平衡常数(填“>”、“<”或“=”)。
2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择下表中最合适的温度和压强分别是__________。该反应420℃时的平衡常数_____520℃时的平衡常数(填“>”、“<”或“=”)。
| 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
420℃ | 0.9961 | 0.9972 | 0.9984 |
520℃ | 0.9675 | 0.9767 | 0.9852 |
620℃ | 0.8520 | 0.8897 | 0.9276 |
(3)在2L密闭容器中模拟接触法制备三氧化硫时,若第12分钟恰好达到平衡,测得生成SO3的物质的量为1.2mol,计算前12分钟用氧气表示反应速率v(O2)为___________。
(4)副产品Y是__。沉淀池中发生的主要反应方程式是___________________。
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是________________。






