题目内容
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
ⅰ.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1
H2S(g)+CO2(g) △H1
ⅱ.氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H2
H2S(g)+CO(g) △H2
已知反应中相关的化学键键能数据如下表:
化学键 | H-H | C=O(COS) | C=S | H-S |
|
E/kJ·mol-1 | 436 | 745 | 580 | 339 | 1076 |
①恒温恒压下,密闭容器中发生反应i。下列事实能说明反应i达到平衡状态的是_______。 (填标号)
a.容器的体积不再改变
b.化学平衡常数不再改变
c.混合气体的密度不再改变
d.形成1molH—O键,同时形成1molH—S键
②一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)

③反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为_____________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。
②Ksp(HgS)=_____________________。
【答案】 d A B C B 33.3% 5S2O82-+2Mn2++8H2O![]() 10SO42-+2MnO4-+16H+ 2SO42-+2H+
10SO42-+2MnO4-+16H+ 2SO42-+2H+![]() S2O82-+H2↑
S2O82-+H2↑ ![]() 4.0×10-53
4.0×10-53
【解析】 (1) ①恒温恒压下,密闭容器中发生反应i:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1。a.该反应属于气体的物质的量不变的反应,恒温恒压下,容器的体积始终不变,不能说明反应是否达到了平衡状态,故错误;b.温度不变,化学平衡常数始终不变,不能说明反应是否达到了平衡状态,故错误;c.气体的质量不变,容器的体积不变,混合气体的密度始终不变,不能故错误;d.形成1molH—O键,表示的是逆反应速率,形成1molH—S键,表示的是正反应速率,形成1molH—O键的同时形成1molH—S键,表示正逆反应速率相等,能够说明反应达到了平衡状态,故正确;故选d;
H2S(g)+CO2(g) △H1。a.该反应属于气体的物质的量不变的反应,恒温恒压下,容器的体积始终不变,不能说明反应是否达到了平衡状态,故错误;b.温度不变,化学平衡常数始终不变,不能说明反应是否达到了平衡状态,故错误;c.气体的质量不变,容器的体积不变,混合气体的密度始终不变,不能故错误;d.形成1molH—O键,表示的是逆反应速率,形成1molH—S键,表示的是正反应速率,形成1molH—O键的同时形成1molH—S键,表示正逆反应速率相等,能够说明反应达到了平衡状态,故正确;故选d;
②一定条件下,密闭容器中发生反应i,根据COS(g)的平衡转化率(![]() )与温度(T)的关系图,曲线上的点表示平衡点,根据方程式,在任何时候都存在v(COS)=v(H2S) ,故答案为:ABC;
)与温度(T)的关系图,曲线上的点表示平衡点,根据方程式,在任何时候都存在v(COS)=v(H2S) ,故答案为:ABC;
③反应ii COS(g)+H2(g)![]() H2S(g)+CO(g) △H2=反应物的键能之和-生成物的键能之和=745+580+436-339×2-1076=+7kJ/mol,升高温度,平衡正向移动,平衡常数增大,对应与曲线A,因此逆反应的平衡常数(K逆)的是B;根据图像,T1℃时,K逆= K正=1,
H2S(g)+CO(g) △H2=反应物的键能之和-生成物的键能之和=745+580+436-339×2-1076=+7kJ/mol,升高温度,平衡正向移动,平衡常数增大,对应与曲线A,因此逆反应的平衡常数(K逆)的是B;根据图像,T1℃时,K逆= K正=1,
COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
起始(mol)2 1 0 0
反应 x x x x
平衡 2-x 1-x x x
则K=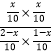 =1,解得x=
=1,解得x=![]() ,COS的平衡转化率=
,COS的平衡转化率=![]() ×100%= 33.3%,故答案为:B;33.3%;
×100%= 33.3%,故答案为:B;33.3%;
(2)①Mn由+2价升到+7价,S2O82-中有两个-1价的氧降到-2价,根据得失电子守恒配平反应,再由电荷守恒确定出产物中有H+,最后由H原子守恒,确定反应物中还有H2O,并配平.得到离子方程式为:2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+,故答案为:2Mn2++5S2O82-+8H2O
2MnO4-+10SO42-+16H+,故答案为:2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+;
2MnO4-+10SO42-+16H+;
②用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵,阳极发生氧化反应,硫酸根离子被氧化为过二硫酸根离子,阴极发生还原反应,氢离子得电子生成氢气,总反应的离子方程式为2SO42-+2H+![]() S2O82-+H2↑,故答案为:2SO42-+2H+
S2O82-+H2↑,故答案为:2SO42-+2H+![]() S2O82-+H2↑;
S2O82-+H2↑;
(3) ①NaHS属于离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
②反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038=
HgS(s)+H+(aq)的平衡常数K=1.75×1038=![]() =
=![]() =
=![]() =
=![]() ,解得:Ksp(HgS)= 4.0×10-53,故答案为:4.0×10-53。
,解得:Ksp(HgS)= 4.0×10-53,故答案为:4.0×10-53。












