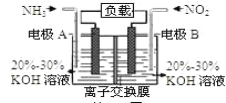
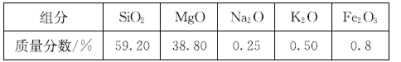
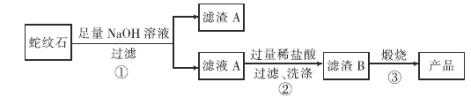
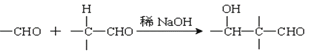
题目内容
【题目】化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基,I可以用E和H在一定条件下合成:
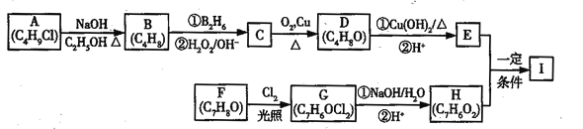
已知以下信息:
①A的核磁共振氢谱表明其只有一种化学环境的氢;
②R﹣CH=CH2![]() R﹣CH2CH2OH;
R﹣CH2CH2OH;
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为_______________________________;
(2)D的结构简式为_______________________________;
(3)E中的官能团名称为___________________________;
(4)F生成G的化学方程式为__________________________,该反应类型为______________;
(5)I的结构简式为_________________________________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,共有____种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式________________________________。
【答案】2﹣甲基﹣2﹣氯丙烷 (CH3)2CHCHO 羧基 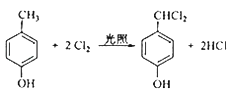 取代反应
取代反应 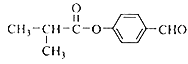 18
18 ![]()
【解析】
A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则A为(CH3)3CCl,在氢氧化钠醇溶液、加热条件下发生消去反应,生成B为CH2=C(CH3)2,根据信息2, B发生反应生成C则C为(CH3)2CHCH2OH,C发生催化氧化生成D,D为(CH3)2CHCHO,D再与氢氧化铜反应,酸化得到E,E为(CH3)2CHCOOH,F的分子式为C7H8O,苯环上的一氯代物只有两种,应含有2个不同的侧链,且处于对位,则F为![]() ,与氯气在光照条件下发生取代反应,生成G为
,与氯气在光照条件下发生取代反应,生成G为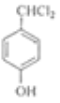 ,G在氢氧化钠水溶液中发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为
,G在氢氧化钠水溶液中发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为![]() ,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为
,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为![]() 。
。
A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则A为(CH3)3CCl,在氢氧化钠醇溶液、加热条件下发生消去反应,生成B为CH2=C(CH3)2,根据信息2, B发生反应生成C则C为(CH3)2CHCH2OH,C发生催化氧化生成D,D为(CH3)2CHCHO,D再与氢氧化铜反应,酸化得到E,E为(CH3)2CHCOOH,F的分子式为C7H8O,苯环上的一氯代物只有两种,应含有2个不同的侧链,且处于对位,则F为![]() ,与氯气在光照条件下发生取代反应,生成G为
,与氯气在光照条件下发生取代反应,生成G为 ,G在氢氧化钠水溶液中发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为
,G在氢氧化钠水溶液中发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为![]() ,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为
,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为![]() 。
。
(1)由上述分析可知,A为(CH3)3CCl,化学名称为2-甲基-2-氯丙烷;
(2)由上述分析可知,D的结构简式为(CH3)2CHCHO;
(3) E为(CH3)2CHCOOH,E中的官能团为羧基;
(4) F与氯气发生取代反应生成G,化学方程式为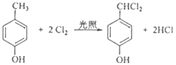 ;
;
(5)由上述分析可知,I的结构简式为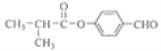 ;
;
(6)I( )的同系物J比I相对分子质量小14,说明J比I少一个CH2原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则J的同分异构体中含有醛基和羧基,侧链可能为:-CHO和-CH2CH2COOH、-CHO和-CH(CH3)COOH、-CH2CHO和-CH2COOH、-CH2CH2CHO和-COOH、-CH(CH3)CHO和-COOH、-CH3和-CH(CHO)COOH,各有邻、间、对三种位置,则符合条件的同分异构体有6×3=18种,J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,而J的同分异构体发生银镜反应并酸化后的产物苯环侧链至少有2种H原子,则产物中苯环上只有1种H原子,产物有2个-COOH,应还含有2个-CH2-,2个侧链相同且处于对位,产物中侧链为-CH2COOH,则符合条件的同分异构体结构简式为:
)的同系物J比I相对分子质量小14,说明J比I少一个CH2原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则J的同分异构体中含有醛基和羧基,侧链可能为:-CHO和-CH2CH2COOH、-CHO和-CH(CH3)COOH、-CH2CHO和-CH2COOH、-CH2CH2CHO和-COOH、-CH(CH3)CHO和-COOH、-CH3和-CH(CHO)COOH,各有邻、间、对三种位置,则符合条件的同分异构体有6×3=18种,J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,而J的同分异构体发生银镜反应并酸化后的产物苯环侧链至少有2种H原子,则产物中苯环上只有1种H原子,产物有2个-COOH,应还含有2个-CH2-,2个侧链相同且处于对位,产物中侧链为-CH2COOH,则符合条件的同分异构体结构简式为:![]() 。
。

【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4①
R—OH+HBr![]() R—Br+H2O②
R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据见下表:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g.cm3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性________(填“大于”、“等于”或“小于”)相应的醇,其原因是______________________________________________________________。
(3)将1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于___________________,但在制备1溴丁烷时却不能边反应边蒸出产物,其原因是___________________________。