题目内容
【题目】能源是现代社会发展的三大支柱之一,化学在提高能源的利用率和开发新能源中起到了重要的作用。电能是现代社会中应用最广泛的二次能源。
(1)下列装置中能够实现化学能转化为电能的是______(填字母)。
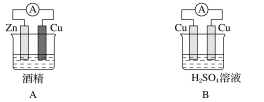

(2)写出该装置正极反应的电极反应式_________。
(3)该装置中溶液里的阴离子移向______________(填电极的化学式)极。
(4)若装置中转移了0.2mol电子,则理论上溶液增加的质量是________。
【答案】C 2H++2e-=H2↑ Zn 6.3g
【解析】
(1)原电池的构成条件有①两个不同导体电极②电解质溶液③自发氧化还原反应④形成闭合回路。A中酒精是非电解质,A项错误;B中两个电极相同,B项错误;C符合原电池的四个条件,C项正确;D没有形成闭合回路,D项错误;答案选C。
(2)写出该装置正极反应的电极反应式 2H++2e-===H2↑
(3)在原电池的电解质中阳离子向正极移动,阴离子向负极移动。所以该装置中溶液里的阴离子移向Zn 极。
若装置中转移了0.2mol电子,根据电极式Zn-2e-=Zn2+则理论上溶液增加Zn2+的物质的质量是0.1mol,则理论上溶液增加的质量,6.3g。

 阅读快车系列答案
阅读快车系列答案【题目】![]() 是一种饲料营养强化剂。一种利用水钴矿(主要成分为
是一种饲料营养强化剂。一种利用水钴矿(主要成分为![]() 、
、![]() ,还含少量
,还含少量![]() 、
、![]() 、MnO等),制取
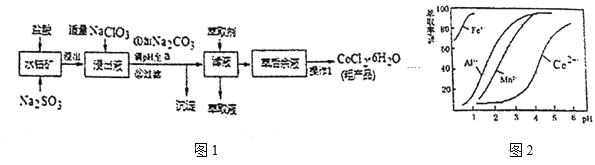
、MnO等),制取![]() 的工艺流程如图1:
的工艺流程如图1:
已知:①浸出液含有的阳离子主要有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等;
等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③![]() 熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
沉淀物 |
|
|
|
|
|
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中![]() 发生反应的离子方程式____。
发生反应的离子方程式____。
(2)写出NaClO3发生反应的主要离子方程式____,若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(3)“加![]() 调pH至a”,过滤所得到的沉淀成分为___。
调pH至a”,过滤所得到的沉淀成分为___。
(4)制得的![]() 在烘干时需减压烘干的源因是___。
在烘干时需减压烘干的源因是___。
(5)萃取剂对金属高子的萃取率与pH的关系如图2。向“滤液”中加入萃取剂的目的是___﹔其使用的最佳pH范围是___。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5