题目内容
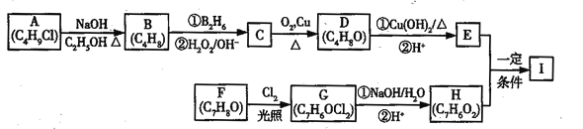
【题目】以乙炔为原料通过以下流程能合成有机物中间体D。

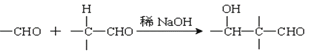
已知:(1)
(2):
请回答下列问题:
(1)化合物A的分子式为___________,1mol A完全燃烧需要消耗_____mol氧气。
(2)反应②的反应类型是:______________;化合物B的名称是:____________。
(3)写出①反应的化学方程式_________________________________________________。
(4)已知1mol HCHO和1mol CH3CH2CHO发生类似已知(2)的反应,生成1molE。写出E的结构简式为:_____________________。
【答案】C4H6O2 4.5 加成反应 1,4—丁二醇 HC≡CH+2HCHO![]() HOCH2C≡CCH2OH
HOCH2C≡CCH2OH ![]()
【解析】
乙炔和甲醛发生加成反应生成A,A与足量氢气反应生成B为HOCH2CH2CH2CH2OH,B发生氧化反应生成C,C为OHCCH2CH2CHO,C发生信息(2)的反应生成D,1mol HCHO和1mol CH3CH2CHO发生类似已知(2)的反应,生成1molE,E为HOCH2CH(CH3)CHO,结合对应的物质的性质以及题目要求解答该题。
根据上述分析可知,则
(1)A的结构简式为HOCH2C≡CCH2OH,则分子式为:C4H6O2,1mol A完全燃烧需要消耗氧气的物质的量为4+![]() -
-![]() = 4.5 mol,
= 4.5 mol,
故答案为:C4H6O2;4.5;
(2)反应②加入足量氢气,碳碳三键变为碳碳单键,反应类型为加成反应生成B为HOCH2CH2CH2CH2OH,其名称为1,4—丁二醇,
故答案为:加成反应;1,4—丁二醇;
(3)根据已知信息可知,乙炔与甲醛反应生成HOCH2C≡CCH2OH 的化学方程式为:HC≡CH+2HCHO![]() HOCH2C≡CCH2OH,
HOCH2C≡CCH2OH,
故答案为:HC≡CH+2HCHO![]() HOCH2C≡CCH2OH;
HOCH2C≡CCH2OH;
(4)根据已知给定反应(2),可知1mol HCHO和1mol CH3CH2CHO在稀氢氧化钠溶液条件下反应可生成1mol![]() ,则E为
,则E为![]() ,
,
故答案为:![]() 。
。

 53随堂测系列答案
53随堂测系列答案