题目内容
11.设NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA | |
| B. | 1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA | |
| C. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度大于3 mol/L |
分析 A、求出钠的物质的量,然后根据钠与氧气的产物无论是氧化钠还是过氧化钠中,均有2mol钠离子~1mol阴离子来分析;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、H218O与D2O的摩尔质量均为20g/mol;
D、Al3+是弱碱阳离子,在溶液中会水解.
解答 解:A、4.6g钠的物质的量为0.2mol,而钠与氧气的产物无论是氧化钠还是过氧化钠中,均有2mol钠离子~1mol阴离子,故0.2mol钠离子~0.1mol阴离子,即含有的阴阳离子的总数为0.3NA个,故A正确;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故0.5mol氯化铁形成的胶粒的个数小于0.5NA个,故B错误;
C、H218O与D2O的摩尔质量均为20g/mol,故2.0g混合物的物质的量为0.1mol,而1molH218O与D2O均含10个中子,故0.1mol混合物中含1mol中子即NA个,故C正确;
D、Al3+是弱碱阳离子,在溶液中会水解,故当含NA个Al3+时,溶液NO3-物质的量大于3 mol,浓度大于3mol/L,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
2.想一想:盐酸、75%的酒精溶液、氯水这些物质为什么归为一类,下列哪些物质还可以和他们归为一类( )
| A. | H2SO4 | B. | 胆矾 | C. | Fe(OH)3胶体 | D. | 液氯 |
19.下列物质的转化过程须加氧化剂的是( )
| A. | CuO→Cu | B. | MnO4-→Mn2+ | C. | Na2SO3→Na2SO4 | D. | Cl2→Cl- |
6.下列各组物质按酸、碱、盐分类顺序排列正确的是( )
| A. | 盐酸、纯碱、石膏 | B. | 硫酸、烧碱、绿矾 | ||
| C. | 碳酸、乙醇、醋酸钠 | D. | 磷酸、熟石灰、可性钾 |
3.在硫化氢的水溶液中,存在以下平衡:H2S═HS-H+、HS-═H++S2-,若使溶液的pH减小,则c(S2-)( )
| A. | 增大 | B. | 减小 | ||
| C. | 不变 | D. | 可能增大也可能减小 |
20.在一密闭容器中,反应aA(g)?bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则( )
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率增大了 | ||
| C. | 物质B的质量分数减小了 | D. | a>b |
1.用NA表示阿伏加德罗常数,下列说法中正确的有( )
| A. | 标准状况下,22.4LH2O含分子数为NA | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2NA | |
| C. | 常温常压下,17g NH3含电子数目为10NA | |
| D. | 2.7g金属铝变成铝离子时失去的电子数为0.1NA |
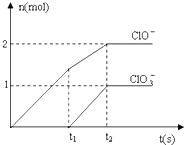 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示. ═2KCl+2MnCl2+5Cl2↑+8H2O
═2KCl+2MnCl2+5Cl2↑+8H2O