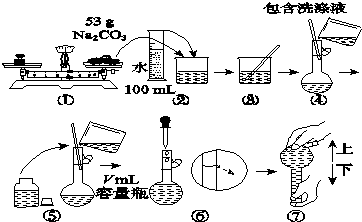
题目内容
1.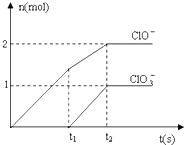 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.(1)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
(2)该石灰乳中含有Ca(OH)2的物质的量是5 mol.
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同.
若在原石灰乳中通入氯气的速度加快,则反应后$\frac{n(Cl{O}^{-})}{n(Cl{O}_{3}^{-})}$<2(填“>”、“<”或“=”);若$\frac{n(Cl{O}^{-})}{n(Cl{O}_{3}^{-})}$=a,则n(C1-)=$\frac{5(a+5)}{a+3}$mol(用含a的代数式来表示).
分析 (1)由图可知,t2时n(ClO-)=2mol,n(ClO3-)=1mol,所以氯气与氢氧化钙反应生成CaCl2、Ca(ClO)2、Ca(ClO3)2、H2O,且n[Ca(ClO)2]:n[Ca(ClO3)2]=2:1,配平书写方程式;
(2)由图可知,t2时氢氧化钙与氯气恰好反应,n(C1O-)=2mol,故n[Ca(ClO)2]=1mol,n(C1O3-)=1mol,故n[Ca(ClO3)2]=0.5mol,根据(1)中方程式计算;
(3)通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n(ClO3-)增多;
由(3)可知,参加反应的氯气n(Cl2)=n[Ca(OH)2]=5mol,根据氯元素守恒可知,n(ClO-)+n(ClO3-)+n(Cl-)=2n(Cl2)=10mol,若n(ClO-)/n(ClO3-)=a,则an(ClO3-)+n(ClO3-)=10-n(Cl-),根据电子转移守恒有,an(ClO3-)+5n(ClO3-)=n(Cl-),联立方程计算.
解答 解:(1)由图可知,t2时n(ClO-)=2mol,n(ClO3-)=1mol,所以n(ClO-)/n(ClO3-)=2,氯气与氢氧化钙反应生成CaCl2、Ca(ClO)2、Ca(ClO3)2、H2O,且n[Ca(ClO)2]:n[Ca(ClO3)2]=2:1,反应方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O,
故答案为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(2)由图可知,t2时氢氧化钙与氯气恰好反应,n(ClO-)=2mol,故n[Ca(ClO)2]=1mol,n(ClO3-)=1mol,故n[Ca(ClO3)2]=0.5mol,根据方程式10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O可知,n[Ca(OH)2]=10n[Ca(ClO3)2]=0.5mol×10=5mol,
故答案为:5;
(3)通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n(ClO3-)增多,所以n(ClO-)/n(ClO3-)<2;
由(3)可知,参加反应的氯气n(Cl2)=n[Ca(OH)2]=5mol,根据氯元素守恒可知,n(ClO-)+n(ClO3-)+n(Cl-)=2n(Cl2)=10mol,若n(ClO-)/n(ClO3-)=a,则an(ClO3-)+n(ClO3-)=10-n(Cl-),根据电子转移守恒有,an(ClO3-)+5n(ClO3-)=n(Cl-),联立方程解得,n(Cl-)=$\frac{5(a+5)}{a+3}$,
故答案为:<;$\frac{5(a+5)}{a+3}$.
点评 本题考查化学图象分析与计算、阅读获得信息的能力等,难度较大,读懂图象与信息判断发生的反应是解题的关键.

| A. | 同浓度的下列溶液:①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4,其中c(NH4+)由大到小的顺序是:①>②>③>④ | |
| B. | 相同温度下,将足量氯化银固体分别放入相同条件的①蒸馏水、②0.1mol•L-1盐酸、③0.1mol•L-1氯化镁溶液、④0.1mol•L-1硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| C. | 常温下将NaHSO3和NaHCO3两溶液 混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(HSO3-)+c(HCO3-)+2c(CO32-)+2c(SO32-) | |
| D. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | V正、V逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ? |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ? | V正=V逆 |
(3)己知:C (s)+$\frac{1}{2}$O2(g)═CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)═H2O (g);△H=-241.8kJ•mo1-1
那么,将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程△H=-78.7kJ•mo1-1.
| A. | 减小容器体积 | B. | 降低温度 | ||
| C. | 加入催化剂 | D. | 恒容下充入HI气体 |
| A. | 不能使用酒精作为萃取剂,因为溴单质在酒精中的溶解度比在水中的小 | |
| B. | 静置分层后有色层在下层,水层几乎无色 | |
| C. | 分液漏斗使用前应当用蒸馏水检验是否漏液 | |
| D. | 振荡、静置分层后,依次用两个不同的烧杯从下口分别接取上下两层液体 |
| A. | 4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA | |
| B. | 1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA | |
| C. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度大于3 mol/L |