题目内容
19.下列物质的转化过程须加氧化剂的是( )| A. | CuO→Cu | B. | MnO4-→Mn2+ | C. | Na2SO3→Na2SO4 | D. | Cl2→Cl- |
分析 氧化剂具有氧化性,在反应中得到电子,必须加入氧化剂才能实现的反应,选项中涉及物质被氧化,所含元素的化合价升高,以此解答.
解答 解:A.Cu元素化合价降低,被还原,应加入还原剂才能实现,故A错误;
B.Mn元素化合价降低,被还原,应加入还原剂才能实现,故B错误;
C.S元素化合价升高,被氧化,应加入氧化剂才能实现,故C正确;
D.Cl元素化合价降低,被还原,应加入还原剂才能实现,姑姑D错误.
故选C.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高考常见题型,注意把握常见反应的特点以及物质的性质,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
9.水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
(2)另有一个容积可变的密闭容器.恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍.平衡时水蒸气的转化率为25%;向该容器中补充 a mol 炭,水蒸气的转化率将不变(填“增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O),最终容器中C16O和C18O 的物质的量之比为1:a.
(3)己知:C (s)+$\frac{1}{2}$O2(g)═CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)═H2O (g);△H=-241.8kJ•mo1-1
那么,将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程△H=-78.7kJ•mo1-1.
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | V正、V逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ? |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ? | V正=V逆 |
(3)己知:C (s)+$\frac{1}{2}$O2(g)═CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)═H2O (g);△H=-241.8kJ•mo1-1
那么,将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程△H=-78.7kJ•mo1-1.
10.苯作萃取剂,并用分液漏斗萃取溴水中的溴单质的实验,下列说法正确的是( )
| A. | 不能使用酒精作为萃取剂,因为溴单质在酒精中的溶解度比在水中的小 | |
| B. | 静置分层后有色层在下层,水层几乎无色 | |
| C. | 分液漏斗使用前应当用蒸馏水检验是否漏液 | |
| D. | 振荡、静置分层后,依次用两个不同的烧杯从下口分别接取上下两层液体 |
7.下列叙述中,错误的是( )
| A. | 新制氯水可使紫色石蕊试液先变红后褪色 | |
| B. | 实验室制取氯气时,常用饱和石灰水来吸收多余的氯气 | |
| C. | 漂白粉在漂白时产生次氯酸,所以漂白粉能使燃料等有机色素褪色 | |
| D. | 钾元素颜色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧置无色,然后再用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察 |
14.下列各组溶液,不用其他试剂,就能将组内物质鉴别出来的是( )
| A. | CuSO4 NaOH BaCl2 HCl | B. | NaCl HCl H2SO4 AgNO3 | ||
| C. | KCl HCl NaOH BaCl2 | D. | NaOH KOH MgCl2 H2SO4 |
4.下列关于气体摩尔体积的几种说法正确的是( )
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 非标准状况下,1mol任何气体不可能占有22.4L体积 | |
| C. | 0.4.molH2、0.2molO2、和0.4molCO2组成的混合气体,在标准状况下约为22.4L | |
| D. | 同温、同压下,相同质量的CO和CO2具有相同的体积 |
11.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA | |
| B. | 1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA | |
| C. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度大于3 mol/L |
8.设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1molAl3+离子含有的电子数为3NA | |
| B. | 1molCl2含有1 NA个原子 | |
| C. | 23g钠在22.4L(标况下)Cl2中反应,转移电子数NA个 | |
| D. | 欲配制1.00L 1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水中 |
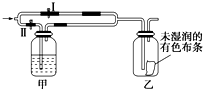 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )