题目内容
20.在一密闭容器中,反应aA(g)?bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则( )| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率增大了 | ||
| C. | 物质B的质量分数减小了 | D. | a>b |
分析 先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向正反应方向移动,则a<b,据此结合选项判断.
解答 解:先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向正反应方向移动,则a<b,
A、假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,大于原来的50%,说明平衡向生成B的方向移动,即向正反应移动,故A错误;
B、根据A的判断,平衡向正反应移动,反应物转化率增大,故B正确;
C、平衡向正反应移动,B的质量增大,混合气体的总质量不变,故物质B的质量分数增大,故C错误;
D、根据A的判断,平衡向生成B的方向移动,则a<b,故D错误;
故选B.
点评 本题考查化学平衡移动问题,题目难度不大,注意通过改变体积浓度的变化判断平衡移动的方向,此为解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
10.苯作萃取剂,并用分液漏斗萃取溴水中的溴单质的实验,下列说法正确的是( )
| A. | 不能使用酒精作为萃取剂,因为溴单质在酒精中的溶解度比在水中的小 | |
| B. | 静置分层后有色层在下层,水层几乎无色 | |
| C. | 分液漏斗使用前应当用蒸馏水检验是否漏液 | |
| D. | 振荡、静置分层后,依次用两个不同的烧杯从下口分别接取上下两层液体 |
11.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA | |
| B. | 1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA | |
| C. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度大于3 mol/L |
8.设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1molAl3+离子含有的电子数为3NA | |
| B. | 1molCl2含有1 NA个原子 | |
| C. | 23g钠在22.4L(标况下)Cl2中反应,转移电子数NA个 | |
| D. | 欲配制1.00L 1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水中 |
15.已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,将1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量(忽略能量损失)( )
| A. | 一定大于92.4 kJ | B. | 一定小于92.4 kJ | C. | 一定等于92.4 kJ | D. | 无法确定 |
5.下列关于甲烷的说法正确的是( )
| A. | 能使溴的四氯化碳溶液褪色 | B. | 是天然气的主要成分 | ||
| C. | 不能发生燃烧反应 | D. | 能发生加成反应 |
9.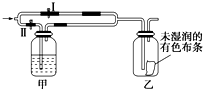 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
①浓硫酸②饱和氯化钠溶液 ③Na2SO3溶液 ④饱和FeBr2溶液.
 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )①浓硫酸②饱和氯化钠溶液 ③Na2SO3溶液 ④饱和FeBr2溶液.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
10.某学习小组为探究原电池工作原理,设计如图装置,下列叙述不正确的是( )
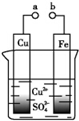

| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Cu2++2e Cu Cu | |
| C. | a和b用导线连接时,Fe为负极,Cu为正极,化学能转化为电能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |