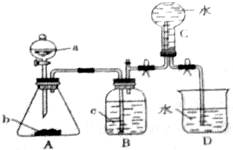
题目内容
5.硫酸锌被广泛应用于工农业生产和医药领域.工业上有氧化锌(主要成分有ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4•7H2O的一种流程如下: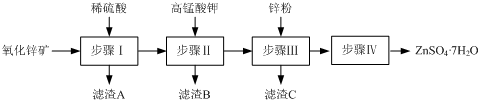
(1)步骤Ⅰ包括酸浸和过滤两个操作.
①酸浸时,需不断通入高温水蒸气的目的是升高温度,使反应物充分混合,以加快反应速率.
②步骤Ⅰ所得溶液中主要含有的金属阳离子为Zn2+、Cu2+、Fe2+.
③过滤时,为防止堵塞,过滤装置需经常用氢氧化钠溶液清洗,其清洗原理是H2SiO3+2NaOH=Na2SiO3+2H2O(用化学方程式表示).
分析 氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,再加高锰酸钾溶液与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4•7H2O晶体;
(1)①根据温度对反应速率的影响分析;
②氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁;
③用氢氧化钠溶液清洗过滤装置,目的是使反应生成的H2SiO3滤渣反应生成Na2SiO3溶解除去;
解答 解:氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,再加高锰酸钾溶液与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4•7H2O晶体;
(1)①酸浸时,不断通入高温水蒸气可使反应液的温度升高,使反应物充分混合,以加快反应速率,
故答案为:升高温度,使反应物充分混合,以加快反应速率;
②氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,滤液中主要含有的金属阳离子为:Zn2+、Cu2+、Fe2+;
故答案为:Zn2+、Cu2+、Fe2+;
③滤渣A为硅酸沉淀,用氢氧化钠溶液清洗过滤装置,目的是使反应生成的H2SiO3滤渣与氢氧化钠反应生成Na2SiO3溶解除去,其发生的反应为:H2SiO3+2NaOH=Na2SiO3+2H2O,
故答案为:H2SiO3+2NaOH=Na2SiO3+2H2O.
点评 本题以ZnSO4•7H2O的制备为知识背景,考查了基本实验操作、氧化还原反应、化学反应速率的影响因素、化学方程式的书写、计算等知识,题目难度中等,侧重于考查学生的分析能力和实验能力.

| A. | 该反应为放热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中只含δ键不含π键 | D. | 设生成1.8gH2O消耗2.24L O2 |
| A. | 植物从土壤中吸收含氮养料 | |
| B. | 豆科植物把含氮化合物转变为蛋白质 | |
| C. | 将空气中的氮气转化为含氮化合物 | |
| D. | NH3经催化氧化生成NO |
①K通常保存在煤油中,以隔绝与空气的接触
②从Li到Cs,碱金属与水反应越来越不剧烈
③钠的焰色反应呈黄色,焰色反应是化学变化
④碱金属阳离子,氧化性最强的是Li+
⑤碱金属的原子半径和离子半径都随核电荷数的增大而增大
⑥从Li到Cs,碱金属的密度越来越大,熔、沸点越来越高
⑦CsOH是强碱,碱性比KOH强
⑧Cs2CO3加热时易分解成CO2和Cs2O.
| A. | ②③⑥⑧ | B. | ②③④⑦ | C. | ④⑤⑥⑧ | D. | ①④⑤⑦ |
| A. | FeCl3 | B. | CuS | C. | Na2O2 | D. | FeS |
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | 1.8gD2O含有NA个中子 | |
| D. | 3.4g氨气中含有0.6NA个N-H键 |
| A. | pH减小 | B. | $\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$增大 | ||
| C. | 水的电离程度先减小后增大 | D. | Kb(NH3•H2O)不变 |
 甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.