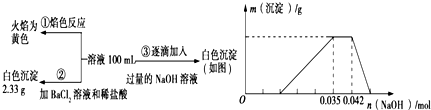
题目内容
4.等质量的O2和O3所含分子的物质的量之比为3:2.分析 氧气、臭氧的摩尔质量分别是32g/mol:48g/mol,根据n=$\frac{m}{M}$计算二者的物质的量之比.
解答 解:氧气、臭氧的摩尔质量分别是32g/mol:48g/mol,相同质量时二者的物质的量之比=$\frac{mg}{32g/mol}$:$\frac{mg}{48g/mol}$=3:2,故答案为:3:2.
点评 本题考查物质的量有关计算,明确各个物理量关系是解本题关键,熟练掌握有关物质的量公式,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
14.一定条件下在容器为2L的密闭容器里加入一定物质的量的A,发生如下反应并建立平衡:A(g)?2B(g),2B(g)?C(g)+2D(g).现测得平衡时各物质的浓度是c(A)=0.3mol/L,c(B)=0.2mol/L,c(C)=0.05mol/L.则最初向容器里加入A的物质的量是( )
| A. | 0.45mol | B. | 0.8mol | C. | 0.9mol | D. | 1.2mol |
15.用过量的H2SO4、NaOH、NH3•H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①②③④是( )

| A. | ①NaCl ②NaOH ③NH3•H2O ④H2SO4 | B. | ①H2SO4 ②NaOH ③NH3•H2O ④NaCl | ||
| C. | ①NaCl ②NH3•H2O ③NaOH ④H2SO4 | D. | ①H2SO4 ②NH3•H2O ③NaOH ④NaCl |
19.某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如表所示,请回答:
(1)三次检测结果中第二次检测结果不正确.
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,需要向溶液中依次滴加HNO3溶液,Ba(NO3)2溶液,AgNO3溶液.(填化学式)
| 检测次数 | 溶液中检测结果 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,需要向溶液中依次滴加HNO3溶液,Ba(NO3)2溶液,AgNO3溶液.(填化学式)
9.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 10mL 18mol/L浓硫酸与足量铜加热充分反应,其中有0.09NA个H2SO4体现了氧化性 | |
| B. | 33.6LCl2一定能与56g铁在加热条件下发生反应 | |
| C. | 12.0g熔融的NaHSO4中含有的阳离子数为0.2NA | |
| D. | 在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有21NA个电子发生转移 |
14.农药波尔多液可用于水果灭虫,是由石灰水和硫酸铜溶液混合而成的悬浊液.它不能用铁制容器盛放,是因为铁与该农药中的硫酸铜起反应.在该反应中,对铁的叙述错误的是( )
| A. | 铁发生还原反应 | B. | 铁发生氧化反应 | C. | 铁是还原剂 | D. | 铁失去电子 |
 .
.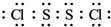 ;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,已知X是能使品红褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓.
;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,已知X是能使品红褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓.