题目内容
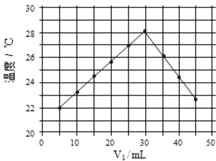
【题目】已知:pKa=-lgKa,25 ℃时,H2SO3 的 pKa1=1.85,pKa2=7.19。常温下,用 0.1 mol·L-1NaOH 溶液滴定 20 mL0.1 mol·L-1H2SO3 溶液的滴定曲线如右图所示。 下列说法不正确的是( )

A. a 点所得溶液中:c(HSO3-)=c(H2SO3)
B. b 点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c 点所得溶液中:c(Na+)=3c(HSO3-)
D. d 点所得溶液中:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
【答案】C
【解析】
A、H2SO3为弱酸,a点溶液中含硫的粒子有SO32-、HSO3 -、H2SO3,根据H2SO3的Ka1=c(HSO3-)×c(H+)/c(H2SO3),根据pKa1=lgKa1有Ka1=10-1.85=c(HSO3-)×10-1.85/c(H2SO3),所以c(HSO3-)=c(H2SO3),故A正确;
B、b点加入氢氧化钠溶液的体积为20mL,与H2SO3恰好生成NaHSO3,根据物料守恒有:c(Na+)=c(SO32-)+ c(HSO3-)+ c(H2SO3),根据电荷守恒有:c(OH-)+2c(SO32-)+c(HSO3-)=c(Na+)+ c(H+),所以有:c(OH-)+2c(SO32-)+c(HSO3-)=c(SO32-)+ c(HSO3-)+ c(H2SO3)+c(H+),故c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故B正确;
C、c点加入的氢氧化钠溶液大于20mL小于40mL,所以生成的溶质为Na2SO3和NaHSO3,根据c点溶液中H2SO3的第二步平衡常数,由pKa2=7.19可得Ka2=10-7.19,又根据Ka2=c(SO32-)×c(H+)/c(HSO3-),c(H+)=10-7.19,所以 c(SO32-)=c(HSO3-),又根据电荷守恒有c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),所以有c(Na+)=c(OH-)+3c(HSO3-)-c(H+),又因为c点呈碱性,c(OH-)>c(H+),所以c(Na+)>3c(HSO3-),故C错误;
D、d点恰好完全反应生成Na2SO3溶液,SO32-水解得到HSO3-,但是水解程度小,故有c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故D正确;
综上所述,本题答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
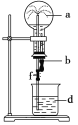
a(干燥气体) | b(液体) | |
A | NO | 水 |
B | CO2 | 4 mol/L NaHCO3溶液 |
C | Cl2 | 饱和NaCl水溶液 |
D | NH3 | 1 mol/L盐酸 |
A. AB. BC. CD. D
【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
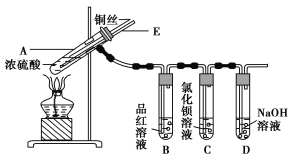
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为____________________________________________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_______________________________。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 | ________ | ________ |
写出其SO2表现还原性的离子反应方程式:______________________________________。
(4) 装置D的作用__________________________________________________________ 。
(5)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是_________________________________________________________________。
【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
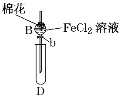
Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
(1)棉花中浸润的溶液为____________,目的是________________。
(2)实验室制备氯气的化学方程式为______________________。
(3)过程Ⅲ中一定发生反应的离子方程式为______________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是_____________________。
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是_______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |