��Ŀ����
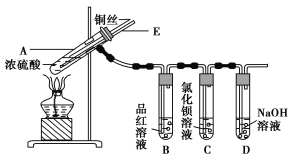
����Ŀ��ijʵ��С��ͬѧΪ��̽��ͭ��Ũ����ķ�Ӧ������������ʵ�飬ʵ��װ����ͼ��ʾ��
ʵ�鲽�裺
����������ͼ��ʾ��װ�ã����������ԣ��ټ����Լ���
�ڼ���A�Թܣ���B�Թ���Ʒ����Һ��ɫ��Ϩ��ƾ��ƣ�
�۽�Cu˿���ϳ鶯�뿪Һ�档
��ش��������⣺
(1)A�Թ��з�����Ӧ�Ļ�ѧ����ʽΪ____________________________________________��
(2)�ܹ�֤��ͭ��Ũ���ᷴӦ���������ʵ��������_______________________________��
(3)��ʢ��BaCl2��Һ��C�Թ��У����˵��ܿ��������⣬���������������������е���Һ�ֳ����ݣ��ֱ�μ�������Һ�������������Ļ�ѧʽ������ж�Ӧ��λ�á�
�μӵ���Һ | ��ˮ | ��ˮ |
�����Ļ�ѧʽ | ________ | ________ |
д����SO2���ֻ�ԭ�Ե����ӷ�Ӧ����ʽ��______________________________________��
(4) װ��D������__________________________________________________________ ��
(5)ʵ����Ϻ���Ϩ��ƾ��ƣ����ڵ���E�Ĵ��ڣ��Թ�B�е�Һ�岻�ᵹ�����Թ�A�У���ԭ����_________________________________________________________________��
���𰸡�Cu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O B�Թ���Ʒ����Һ��ɫ BaSO4 BaSO3 SO2��Cl2��2H2O===4H����SO42-��2Cl��(��Ba2����SO2��Cl2��2H2O===BaSO4����4H����2Cl��) ��ȥʣ���SO2(��β������) ��A�Թ�������ѹǿ��Сʱ��������E���ܽ���A�Թ��У�ά��A�Թ���ѹǿƽ��
CuSO4��SO2����2H2O B�Թ���Ʒ����Һ��ɫ BaSO4 BaSO3 SO2��Cl2��2H2O===4H����SO42-��2Cl��(��Ba2����SO2��Cl2��2H2O===BaSO4����4H����2Cl��) ��ȥʣ���SO2(��β������) ��A�Թ�������ѹǿ��Сʱ��������E���ܽ���A�Թ��У�ά��A�Թ���ѹǿƽ��
��������
����ʵ��ԭ������Ӧ������ʷ�����Ӧ�����з����ķ�Ӧ�����ݶ�����������ʷ�������д��ط���ʽ������ʵ��װ�÷������������ú�ԭ����
(1)A�Թ��з�������Cu��Ũ��������SO2�ķ�Ӧ��Cu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O���ʴ�Ϊ��Cu��2H2SO4(Ũ)
CuSO4��SO2����2H2O���ʴ�Ϊ��Cu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O��
CuSO4��SO2����2H2O��
(2)����SO2��ʹƷ����Һ��ɫ��������֤��Cu��Ũ���ᷴӦ������SO2���壬
�ʴ�Ϊ��B�Թ���Ʒ����Һ��ɫ��
(3)��ˮ�е�Cl2���������ԣ��ܽ�SO2����ΪSO42-��SO42-��Ba2����Ӧ����BaSO4��������ˮ���м��ԣ�����SO2����SO32-��SO32-��Ba2����Ӧ����BaSO3������������������ԭ���ķ�ӦΪ��SO2��Cl2��2H2O===4H����SO42-��2Cl����
�ʴ�Ϊ�� BaSO4 �� BaSO3��SO2��Cl2��2H2O===4H����SO42-��2Cl��(��Ba2����SO2��Cl2��2H2O===BaSO4����4H����2Cl��)��
(4)��Ӧ���ɵĶ��������ж���Dװ���е�����������Һ�������ն�������
�ʴ�Ϊ�� ��ȥʣ���SO2(��β������) ��
(5)����װ���ص�����õ�A�Թ�������ѹǿ��Сʱ��������E���ܽ���A�Թ��У�ά��A�Թ���ѹǿƽ�⣬
�ʴ�Ϊ����A�Թ�������ѹǿ��Сʱ��������E���ܽ���A�Թ��У�ά��A�Թ���ѹǿƽ��

 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�