题目内容
【题目】多年来,储氢材料、光催化剂与硼酸盐材料的研究一直是材料领域的热点研究方向。回答下列问题:
一种Ru络合物与g-C3N4符合光催化剂将CO2还原为HCOOH的原理如图。
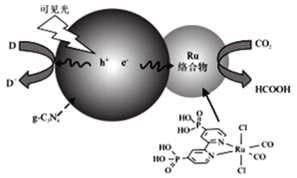
(1)Ru络合物中第二周期元素的第一电离能由大到小的顺序为___,Ru络合物含有的片段![]() 和
和![]() 中都存在大π键,氮原子的杂化方式为___,氮原子配位能力更强的是___(填结构简式)
中都存在大π键,氮原子的杂化方式为___,氮原子配位能力更强的是___(填结构简式)
(2)基态碳原子的价电子排布图为___,HCOOH的沸点比CO2高的原因是___。
(3)2019年8月13日中国科学家合成了白光材料Ba2[Sn(OH)6][B(OH)4]2,[B(OH)4]-中B的价层电子对数为____,[Sn(OH)6]2-中,Sn与O之间的化学键不可能是___。
a.π键 b.σ键 c.配位键 d.极性键
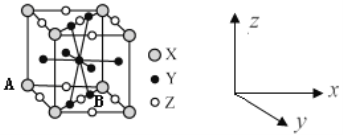
(4)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为___(填化学式)。若原子分数坐标A为(0,0,0),则B(Y)的原子分数坐标为___,已知LaNi5H6摩尔质量为499g·mol-1,晶体密度为g·cm-3,设NA为阿伏加德罗常数的值,则晶胞参数为a=___pm(用代数式表示)。
【答案】N>O>C sp2 ![]()
![]() HCOOH和CO2都为分子晶体,HCOOH分子间形成氢键 4 a H2 (
HCOOH和CO2都为分子晶体,HCOOH分子间形成氢键 4 a H2 (![]() ,
,![]() ,0)
,0)  ×1010
×1010
【解析】
根据元素第一电离能的变化趋势比较元素的第一电离能的大小关系,根据杂化轨道理论和大π键的成键特点判断氮原子的轨道杂化方式,根据配位键的成键条件判断![]() 和
和![]() 中谁的氮原子配位能力更强。根据价层电子对互斥理论分析中心原子的价层电子对数,根据Sn与O的成键特点判断其所形成的化学键类型。根据均摊法确定晶胞中各种微粒的个数,再结合晶体的化学式确定微粒Z的类型,根据晶胞结构及其粒子的空间分布特点判断其坐标参数,根据晶胞的密度和质量计算晶胞的边长。
中谁的氮原子配位能力更强。根据价层电子对互斥理论分析中心原子的价层电子对数,根据Sn与O的成键特点判断其所形成的化学键类型。根据均摊法确定晶胞中各种微粒的个数,再结合晶体的化学式确定微粒Z的类型,根据晶胞结构及其粒子的空间分布特点判断其坐标参数,根据晶胞的密度和质量计算晶胞的边长。
(1)同周期从左向右元素的第一电离能总体呈增大趋势,但是第ⅤA族元素比同周期的第ⅥA族元素的第一电离能大,故N、O、C的第一电离能依次减小;![]() 和
和![]() 中都存在大π键,氮原子均采用sp2杂化,
中都存在大π键,氮原子均采用sp2杂化,![]() 的大π键为π66,N原子有一对孤电子对,
的大π键为π66,N原子有一对孤电子对,![]() 的大π键为π56,N原子无孤电子对,因此氮原子配位能力更强的是
的大π键为π56,N原子无孤电子对,因此氮原子配位能力更强的是![]() ,故答案为:N>O>C;sp2;
,故答案为:N>O>C;sp2;![]() ;
;
(2)碳原子为6号元素,根据构造原理可写出基态碳原子的电子排布式为1s22s22p2,故基态碳原子的价电子排布图为![]() ;HCOOH和CO2都为分子晶体,但是HCOOH分子间可形成氢键,故HCOOH的沸点比CO2高;
;HCOOH和CO2都为分子晶体,但是HCOOH分子间可形成氢键,故HCOOH的沸点比CO2高;
(3)[B(OH)4]-中硼原子连接四个羟基,其价层电子对数为4;[Sn(OH)6]2-的中心离子Sn4+与OH-之间形成配位键,配位键是一种特殊的共价键,则Sn与O之间形成的化学键属于σ键或极性键,不可能是π键,故答案为:4;a;
(4)根据均摊法可知,晶胞中,微粒X的个数为![]() ,微粒Y的个数为
,微粒Y的个数为![]() ,微粒Z的个数为
,微粒Z的个数为![]() ,根据储氢后所得晶体的化学式LaNi5H6,可知微粒Z为H2;根据晶胞结构图可知,B(Y)的原子分数坐标为(
,根据储氢后所得晶体的化学式LaNi5H6,可知微粒Z为H2;根据晶胞结构图可知,B(Y)的原子分数坐标为(![]() ,
,![]() ,0);晶胞边长
,0);晶胞边长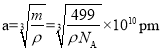 ,故答案为:H2;(
,故答案为:H2;(![]() ,
,![]() ,0);
,0); ×1010。
×1010。

 阅读快车系列答案
阅读快车系列答案【题目】针对下表中的9种元素,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
(1)写出⑧的原子结构示意图:_________________________。
(2)形成物质种类最多的元素是__________________。
(3)用电子式表示⑤和⑨形成化合物的过程__________________。
(4)⑤⑥⑦最高正价氧化物对应水化物碱性由强至弱的顺序是_____________。
(5)④的单质与甲醇(CH3OH)形成的碱性燃料电池的负极方程式:________________。
(6)写出⑦的单质与三氧化二铁反应的化学方程式____________________。
(7)③和④的气态氢化物的稳定性顺序为:______________。④和⑧的气态氢化物的沸点顺序为:_____________,出现这种变化的原因是:_____________。