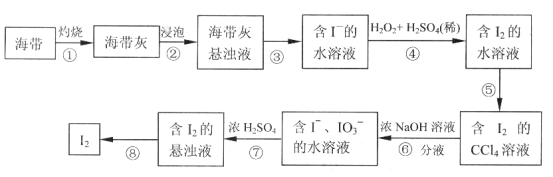
题目内容
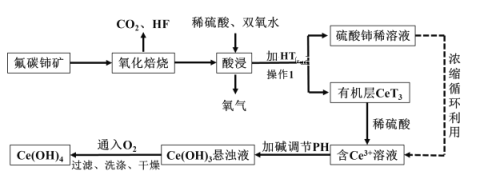
【题目】氢氧化铈Ce(OH)4是一种重要的稀土氢氧化物,它可由氟碳酸铈矿(主要含CeFCO3)经如下流程获得:
已知:在酸性溶液中![]() 有强氧化性,回答下列问题:
有强氧化性,回答下列问题:
(1)氧化培烧时不能使用陶瓷容器,原因是_____________________________________。
(2)氧化焙烧生成的铈化合物二氧化铈(CeO2),其在酸浸时反应的离子方程式为___________;
(3)已知有机物HT能将![]() 从水溶液中萃取出来,该过程可表示为:
从水溶液中萃取出来,该过程可表示为:![]() (水层)+
(水层)+![]() (有机层)
(有机层)![]()
![]() +
+![]() (水层)从平衡角度解释:向
(水层)从平衡角度解释:向![]() (有机层)加入
(有机层)加入![]() 获得较纯的含
获得较纯的含![]() 的水溶液的原因是________________;
的水溶液的原因是________________;
(4)取某Ce(OH)4产品0.50g,加硫酸溶解后,与23.00mL0.1000mol/L的FeSO4溶液恰好完全反应(铈被还原成Ce3+).(已知:Ce(OH)4的相对分子质量为208)
①FeSO4在该反应中作________剂(填“氧化”或“还原”);
②计算Ce(OH)4产品的纯度____________;
③若用硫酸酸化后改用0.1000mol/L的FeCl2溶液滴定产品从而测定Ce(OH)4产品的纯度,其它操作都正确,则测定的Ce(OH)4产品的纯度____________(填“偏高”、“偏低”或“无影响”)。
【答案】陶瓷会与生成的HF反应 2CeO2+H2O2+6H+==2Ce3++O2↑+4H2O 混合液中加硫酸导致氢离子浓度增大,平衡向生成![]() 水溶液方向移动 还原 95.68% 偏低
水溶液方向移动 还原 95.68% 偏低
【解析】
氟碳铈矿主要化学成分为CeFCO3,用硫酸强化焙烧得浸出液中含有,氟离子、铈离子、硫酸等,尾气中主要含有二氧化碳,加入碳酸钙会生成硫酸钙和氟化钙等难溶物为滤渣,和硫酸稀土溶液,在硫酸稀土溶液中加入萃取剂HT,经过分液将溶液中的Ce3+萃取出来,再加入稀硫酸得含有Ce3+的溶液,调节溶液的pH值得Ce(OH)3沉淀,再经过氧气氧化,过滤、洗涤、干燥可得Ce(OH)4产品;
(1)CeFCO3在氧化焙烧得过程中,会产生HF,陶瓷会与生成的HF反应;
(2)根据含有过氧化氢判断,发生的是氧化还原反应,而不是金属氧化物和的反应,离子反应方程式为:2CeO2+H2O2+6H+==2Ce3++O2↑+4H2O;
(3)根据反应是可逆反应,混合液中加硫酸导致氢离子浓度增大,平衡向生成![]() 水溶液方向移动;
水溶液方向移动;
(4)①根据铈被还原成Ce3+,判断亚铁离子变成三价铁离子,所以铁作还原剂;
②根据计算得出,含有0.0023mol的亚铁离子,亚铁离子变成铁离子,失去0.0023mol的电子,同时铈被还原成Ce3+,也是得到一个电子,说明一共有0.0023mol的Ce(OH)4,0.0023mol![]() 208g/mol=0.4784g,所以Ce(OH)4产品的纯度为
208g/mol=0.4784g,所以Ce(OH)4产品的纯度为![]() 100%=95.68%。
100%=95.68%。
③因为在酸性溶液中Ce4+有强氧化性,若没有经过硫酸酸化,参加反应的Ce4+较少,会导致产品的纯度偏低。

【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D