题目内容
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是
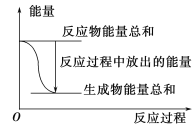
A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
【答案】D
【解析】
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) △H<0,反应为放热反应,说明反应物的总能量大于生成物的总能量,当将该反应设计为原电池时,Zn为负极,被氧化,正极上H+获得电子,析出氢气,以此解答该题。
A.反应为放热反应,说明反应物的总能量大于生成物的总能量,图示正确,选项A正确;
B.热化学方程式中,反应热与物质的物质的量呈正比,选项B正确;
C.反应中Zn被氧化生成ZnSO4,当将该反应设计为原电池时,Zn为负极,失去电子,被氧化,发生氧化反应,选项C正确;
D.若将其设计为原电池,当有32.5g锌溶解时,n(Zn)=32.5g÷65g/mol=0.5mol,n(e-)=2 n(Zn)=2×0.5mol=1mol,根据在同一闭合回路中电子转移数目相等,可知在正极放出气体的物质的量是n(H2)= 0.5mol,在标况下体积为V(H2)= 0.5mol×22.4L/mol= 11.2L,但由于未指明气体所处的环境,所以不能确定气体的体积,选项D错误;
故合理选项是D。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化变成绿色;见光分解变成褐色。如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl)生产CuCl的流程:
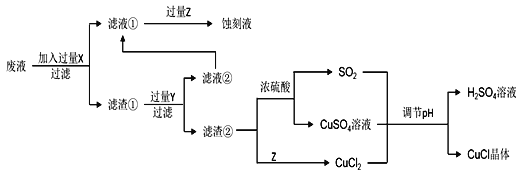
根据以上信息回答下列问题:
(1)生产过程中X的化学式为____。
(2)写出产生CuCl的离子方程式:____。
(3)实验探究pH对CuCl产率的影响如表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为____,当pH较大时CuCl产率变低原因是____。调节pH时,___(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是____。
(4)氯化亚铜的定量
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解。
②用0.10mol·L1硫酸铈标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。三次平行实验结果如表(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_____。(结果保留三位有效数字)。
(5)由CuCl水解再热分解可得到纳米Cu2O。第一步CuCl水解的离子方程式为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。
CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。