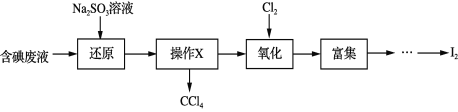
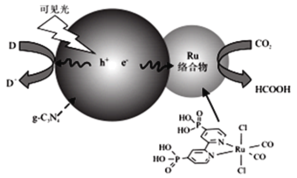
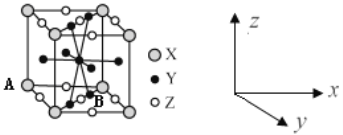
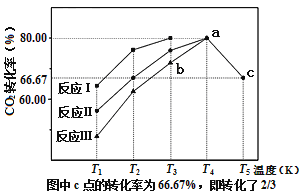
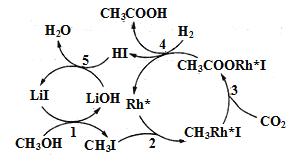
题目内容
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01molL-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O![]() 的水解)。已知Ksp(AgCl)数量级为10-10。下列叙述不正确的是( )
的水解)。已知Ksp(AgCl)数量级为10-10。下列叙述不正确的是( )
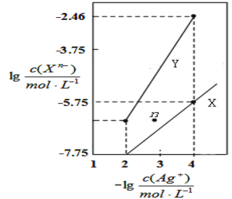
A.Ksp(Ag2C2O4)数量级为10-11
B.n点表示Ag2C2O4的过饱和溶液
C.向c(Cl-)=c(C2O![]() )的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
)的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
D.Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O
2AgCl(s)+C2O![]() (aq)的平衡常数为10-0.71
(aq)的平衡常数为10-0.71
【答案】BD
【解析】
若曲线X为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)c(Cl)=104×105.75=109.75=100.25×1010,则数量级为10-10,若曲线Y为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)c(Cl)=104×102.46=106.46=100.54×107,则数量级为10-7,又已知Ksp(AgCl)数量级为10-10,则曲线X为AgCl的沉淀溶解平衡曲线,则曲线Y为Ag2C2O4的沉淀溶解平衡曲线,Ksp(Ag2C2O4)=c2(Ag+)c(C2O42-)=(104)2×(102.46)=1010.46,据此分析解答。
A. 由以上分析知,曲线Y为Ag2C2O4的沉淀溶解平衡曲线,Ksp(Ag2C2O4)=c2(Ag+)c(C2O42-)=(104)2×(102.46)=1010.46=100.54×1011,则Ksp(Ag2C2O4)数量级为10-11,故A正确;
B. 曲线Y为Ag2C2O4的沉淀溶解平衡曲线,n点的离子积Qc(Ag2C2O4)<Ksp(Ag2C2O4),故为Ag2C2O4的不饱和溶液,故B错误;
C. 根据图象可知,当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小于生成Ag2C2O4沉淀所需的c(Ag+),故向c(Cl)=c(C2O42-)的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,故C正确;
D. Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数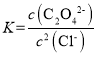 ,此时溶液中的c(Ag+)相同,故有
,此时溶液中的c(Ag+)相同,故有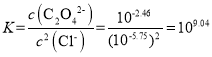 ,故D错误;
,故D错误;
故选BD。

【题目】为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

实验操作 | 实验现象 |
ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
ⅲ.打开B中分流漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是____。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是____。
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是___。
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)ⅲ中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br―
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是________。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是____。
【题目】已知:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某同学探究硫代硫酸钠与酸反应速率的影响因素,设计了一系列如下实验:
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL-1) | V/mL | c/(molL-1) | V/mL | ||
A | 10 | 5 | 0.1 | 5 | 0.1 | 5 |
B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
C | 30 | 5 | 0.1 | 5 | 0.1 | 5 |
D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
(1)实验过程中为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率大小________________________。
(2)若要探究温度对反应速率的影响,可以选择实验中的哪些组合来比较_______(填组号)。
(3)利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可定量测定市售硫代硫酸钠的纯度,现称硫代硫酸钠固体样品配成溶液,取一定量溶液置于锥形瓶中,加入指示剂,用碘水滴定。回答下列各题:
①实验中滴定管应选择_________(填酸式或碱式)滴定管,滴定前可以选择_____作为指示剂,滴定终点时的现象为_________________。
②下列操作测得硫代硫酸钠的含量偏大的是(__________)
A.滴定前滴定管内有气泡,滴定后气泡消失
B.读取碘水体积刻度时,滴定前平视,滴定后俯视
C.滴定过程中,锥形瓶震荡过于剧烈,有少量溶液溅出
D.滴定管用蒸馏水洗净后,直接加入碘水溶液